金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。

请回答下列问题。
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C===2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为______;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_________。
(2)上述生产流程中加入铁屑的目的是___________。此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
| Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.001 8 mol/L,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为____________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为_______。Mg还原TiCl4过程中必须在1070 K的温度下进行,你认为还应该控制的反应条件是_______。除去所得金属钛中少量的金属镁可用的试剂是______。
(4)在800~1 000 ℃时电解TiO2也可制得海绵钛,装置如下图所示。

图中b是电源的________极,阴极的电极反应式为________。
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题: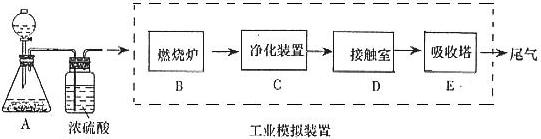
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为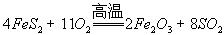 ,在该反应中____________做氧化剂,若消耗了
,在该反应中____________做氧化剂,若消耗了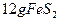 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_____________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成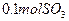 ,可放出
,可放出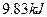 的热量,请写出该反应的热化学方程式__________________________________________;
的热量,请写出该反应的热化学方程式__________________________________________;
并回答在工业中不采取加压措施的原因
__________________________________________________________________;
(5)为检验从接触室出来的气体成分,甲同学设计如下实验: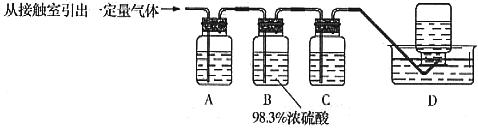
①A中盛放的试剂是____________________;
②B中盛放98.3%浓硫酸的作用是__________________________________________,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案________(填“可行”或“不可行”)说明理由_________________________________________________
_______________________________;
③C中盛放的试剂是___________________________,其作用是__________________。
一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
I.甲同学的方案如图所示: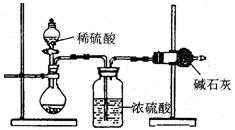
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分
数的数据存在较大的偏差,你认为原因可能是(填序号)。
| A.装置内原有空气中的二氧化碳气体也被碱石灰吸收 |
| B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收 |
| C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收 |
| D.加入稀硫酸的量不足,则可能造成误差 |
II.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,
称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)洗涤沉淀的操作要点是。
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是。
(1)下图分别是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是。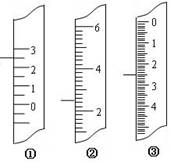
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL



 C.③是滴定管,读数为3.5mL
C.③是滴定管,读数为3.5mL
D.①是温度计,读数为2.5℃
(2)实验室里不同化学试剂的保存方法不尽相同。下图中A、B、C、D、E是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内(多选倒扣分):
①NaOH溶液 ②浓硫酸 ③Na2CO3溶液 ④白磷 ⑤大理石 ⑥酒精 ⑦氯水 ⑧浓硝酸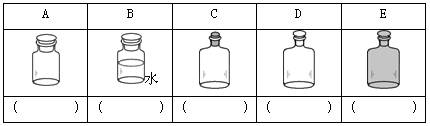
下列仪器中,根据物质的沸点不同分离物质时需要的是(填编号)。
①容量瓶 ②普通漏斗 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管
⑦燃烧匙 ⑧温度计 ⑨干燥管
下列实验操作或对实验事实的描述不正确的是(填序号)
①已烷中混有已烯,加入足量的溴水,充分振荡,静置分层后分离
②配置硫酸铜溶液时应向溶液中加入少量的铜粉
③实验室可以用双氧水和二氧化锰制取少量的氧气
④向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成