氮可形成多种氧化物,如NO、NO2、N2O4等。
(1)电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____,理由是:_____________________________。

(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2‾)和c(CH3COO‾)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400 mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g) N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
| 时间/s |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0. 08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol/(L.min);n3 n4(填“>”、“<”或“=”),该反应的平衡常数的值为 。
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是 mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为 。
.草酸亚铁晶体(FeC2O4·2H2O)常用作分析试剂及显影剂等。下图是将一定质量的草酸亚铁在氩气氛围中进行热重分析的示意图(TG%表示残留固体质量占原样品质量的百分数)。请回答下列问题:
(1)B处残留物的化学式为。C处残留物的化学式为。
(2)A→C整个反应过程中总反应的化学方程式为。
(3)上述FeC2O4·2H2O在氩气气氛中进行热重分析的原因是。
若将分解得到的600℃时的固体与足量的浓硫酸反应后,将溶液浓缩、冷却,有带9个结晶水的晶体析出,该晶体的化学式为。
(4)现取1.44gFeC2O4放在某真空的密闭容器中,再充入0.04molCO,加热至1100℃,其中反应:FeO(s) + CO(g) 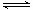 Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为。
写出下列基团(或官能团)的名称或结构简式:
-CH2CH3 、-OH 、异丙基: 、醛基 、羧基 、
为了测定某有机物A的结构,做如下实验: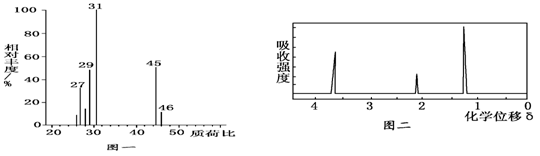
①将9.2g该有机物完全燃烧,生成0.4 mol CO2和10.8 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3.试回答下列问题:
(1)有机物A的相对分子质量是________.(2)有机物A的实验式是________.
(3)能否根据A的实验式确定A的分子式________(填“能”或“不能”),若能,则A的分子式是________(若不能,则此空不填).(4)写出有机物A可能的结构简式_______.
某有机物由C、H、O三种元素组成,它的红外吸收光谱表明有羟基O-H键和烃基C-H键的红外吸收峰,且烃基与羟基上氢原子个数比为2:1,它的相对分子质量为62,试写出该有机物的结构简式。
某烯烃与H2发生加成反应后得到的产物是CH3—CH(CH3)2.
⑴该产物的名称是;⑵原来烯烃的结构简式为:;
⑶写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式: