氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。
(1)根据性质,推测氮化硅属于________晶体。
(2)根据化合价规律,推测氮化硅的化学式为_________。
(3)现用四氯化硅和氮气、氢气加强热反应,可得较高纯度的氮化硅,反应的化学方程式为______ ___________。
(10分)榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下: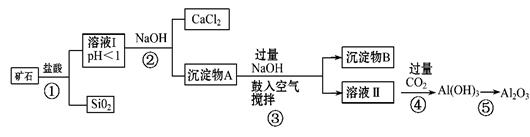
(1)SiO2的用途广泛,试写出其中的一种重要用途;
(2)溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有;
(3)步骤③中NaOH参加反应的离子方程式是,
鼓入空气并充分搅拌的目的是(用化学方程式表示):。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是 ________。
(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3— + 4H+ + 3e- NO↑+2H2O; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
NO↑+2H2O; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:。
(2)反应中硝酸体现了等化学性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是。
(6分)(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
CO(g)+3H2(g)ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g) CH3OH(g)ΔH="-129.0" kJ·mol-1
CH3OH(g)ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____________。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+ 氧化成Co3+,然后以Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式 _______。
②写出Co3+除去甲醇的离子方程式。
(8分)工业生产硝酸铵的流程图如下:请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_____________________________(任写一条)。
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量___________(填“<” “>” “=”)92.4kJ,理由是。
(3)写出氨催化氧化的化学方程式:___________________________________________________。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
2.0 |
1.0 |
0.8 |
0.7 |
0.7 |
0.7 |

(1)已知升高温度,NO2的浓度减小,则该反应是热反应。
(2)下图中表示NO2的变化的曲线是用O2表示从0~2 s内该反应的平均速率v =
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效催化剂