某校化学小组的同学开展了一系列的化学实验活动。

(1)甲同学用图1所示装置,测量锌与硫酸反应速率;把2g锌粒放入锥形瓶内,通过分液漏斗加入1mol·L—1稀硫酸40mL收集10mL气体,通过记录 得到反应速率为XmL·min—1。实验开始时检查该装置气密性的方法是 。
(2)乙同学用图2装置测定Na2CO3和NaCl的固体混合物中Na2CO3的质量分数:
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于 、 仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是 ;
③仪器甲、乙接口的连接方式如下:A连接 ,B连接 ,C连接 (填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是 。如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 。
(16分)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为。
(2)固体混合物B的组成为;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为
。
(3)完成煅烧中的化学方程式:CuO + Al2O3 CuAlO2 + ↑
CuAlO2 + ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是、过滤、洗涤和干燥。
“向海洋进军”,已成为世界许多国家发展的战略口号,海水中通常含有较多的Ca2+、Mg2+、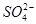 等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下: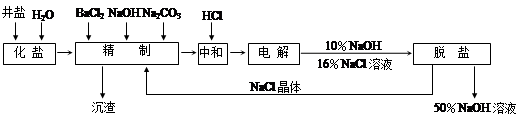
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为 ;
(2)电解过程的总反应的化学方程式_________________________________________。
(3)电解槽阳极产物可用于_____________________________(至少写出两种用途)。
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:。
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| NaOH /g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
| NaCl/ g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐工序中利用通过 、 (填操作名称)除去NaCl。
氯元素(Cl)是最重要的“成盐元素”,主要以NaCl的形式存在于海水和陆地的盐矿中。食盐不仅是人体必需的物质,而且是重要的化工原料,从海水中提取氯并应用于工农业生产中的图示如下。
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质、精制后可得饱和NaCl溶液。精制时通常在溶液中依次加入的试剂及操作正确的是 ;
A.过量的BaCl2 过量NaOH
过量NaOH 过量Na2CO3
过量Na2CO3 过滤
过滤 过量HCl
过量HCl
B.过量的NaOH  过量Na2CO3
过量Na2CO3 过量BaCl2
过量BaCl2 过滤
过滤  过量HCl
过量HCl
C.过量的BaCl2 过量Na2CO3
过量Na2CO3 过量NaOH
过量NaOH  过滤
过滤  过量HCl
过量HCl
D.过量的NaOH 过量 BaCl2
过量 BaCl2 过量Na2CO3
过量Na2CO3  过量HCl
过量HCl 过滤
过滤
写出加入盐酸后可能发生的化学反应的离子方程式。
(2)工业上用电解饱和食盐水的方法制取烧碱和氢气、氯气。下图是电解饱和食盐水装置的一部分,请将装置补充完整,并标出阴阳极和通电时溶液中离子移动的方向。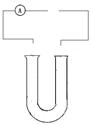
阴极反应式为 ;反应类型(填氧化或还原反应),
总电极反应式为。
(3)在实验室中用浓盐酸与MnO2共热可制取Cl2。
① 下列收集Cl2的装置正确的是;
②检验是否有氯气生成可采用的方法是;
A.用干燥的蓝色石蕊试纸B.用干燥的有色布条
C.用湿润的淀粉碘化钾试纸 D.将气体通入硝酸银溶液
③ 将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式。
④ 如下图所示,往漂粉精溶液中持续通入SO2 的过程中,可观察到的现象有(至少写出两点)。
实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________
(2)甲试管中混合溶液的加入顺序:___________________________________;
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
| A.中和乙酸和乙醇。 |
| B.中和乙酸并吸收部分乙醇。 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。 |
| D.加速酯的生成,提高其产率。 |
(4)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器________(填:“下口放” 或“上口倒”)出。
(5)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)__________
①混合物中各物质的浓度不再变化;②单位时间里,生成1mol乙醇,同时生成1mol乙酸;③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸.
工业上从海水中提取溴的方法如下:
①将蒸馏(制淡水)后浓缩的海水用硫酸进行酸化;
②向酸化的海水中通入足量氯气,使溴离子转化为溴单质;
③向上述溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫水溶液的吸收塔内转化成氢溴酸;
④向吸收塔内通入适量的氯气;
⑤用四氯化碳萃取吸收塔中的溴单质。
请完成下列问题:
(1)在实验室中蒸馏海水制淡水时,常用的仪器除了酒精灯、锥形瓶、牛角管、冷凝管、石棉网及必要的夹持仪器,还需要的玻璃仪器有;蒸馏时碎瓷片的作用是______________________
(2)步骤②中反应的离子方程式为。
(3)步骤③的目的是使溴单质富集,试写出溴单质与二氧化硫水溶液反应的化学方程式。
反应中________(写化学式)是氧化剂。1mol氧化剂在反应中得到_______mol电子。
(4)下列能代替四氯化碳来萃取溴的试剂是 _________(填序号)
| A.盐酸 | B.酒精 | C.乙酸 | D.苯 |