在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水.某化学课外兴趣小组对碳的氧化物的成分进行了实验探究.
【提出问题】如何通过实验确定碳的氧化物的成分.
【猜想】
| 猜想1 |
猜想2 |
猜想3 |
| 只有CO |
只有 |
CO和CO2都有 |
【设计实验】基于猜想3,兴趣小组同学设计了如图实验装置:

【实验探究】
(1)实验过程中观察到 装置(填字母)中的澄清石灰水变浑浊,证明草酸分解时有CO2气体产生,A中发生的化学方程式为_____________________________
(2)实验过程中还观察到以下实验现象:①C装置中澄清石灰水不变浑浊;②E装置中__________________;③F装置中 ,证明有CO气体.
【实验结论】通过实验探究证明:猜想3成立.草酸分解的化学方程式是 .
【问题讨论】
(1)C装置的作用是
(2)装置末端酒精灯的作用是 .
【计算】兴趣小组的四位男同学对学校角落的一堆石灰石产生了兴趣,他们想知道其中含碳酸钙的质量分数,于是他们取来了一些石灰石,并取稀盐酸200g,平均分成4份,每人进行了一次实验,结果如下:
| 实验 |
1 |
2 |
3 |
4 |
| 加入样品的质量/g |
5 |
10 |
15 |
20 |
| 生成CO2的质量/g |
1.54 |
3.08 |
4.4 |
m |
①m的数值是 .
②请你协助他们计算这种石灰石中碳酸钙的质量分数?(写出完整的计算过程)
为了验证铁锈蚀的条件,进行了如下图(略去了其中的夹持装置)所示三个对比实验。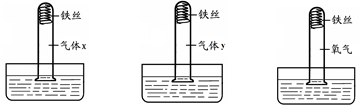
A B C
(1)一段时间后,A中铁丝发生锈蚀且试管中液面上升,B和C中均无明显现象。实验A中铁丝被锈蚀,是铁丝与________同时作用的结果;实验B中气体y具备的性质是________;进行实验C的目的是________。
(2)三个实验中,水槽中盛放的液体分别为________。
某无色溶液由石灰水、盐酸、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的两种组成。
已知:氯化钙溶液为中性,碳酸钠溶液为碱性,Na2CO3 + CaCl2 =CaCO3↓ + 2NaCl。
(1)若取适量样品放入试管中,滴加无色酚酞溶液,溶液为无色。溶液的组成是________。
(2)若取适量样品放入试管中,滴加无色酚酞溶液,溶液变成红色,再向试管中加入过量的氢氧化钙溶液,观察到有沉淀产生,反应的化学方程式为________;样品中一定含有的物质是________。过滤,滤液仍为红色,滤液中除酚酞以外,还一定含有的溶质为________。为确定样品组成,取适量样品放入试管中,滴加过量的氯化钙溶液,再滴加________溶液,可以证明溶液中是否含有________。
初中化学课上,同学们利用下列实验探究碱的化学性质:
(1)A实验中发生反应的化学方程式为。
(2)B实验中观察到塑料瓶变瘪的现象,产生此现象的原因是。
(3)C实验中可观察到的现象是。
(4)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。
【提出问题】 废液中含有什么物质?
【假设猜想】 通过分析上述实验,同学们猜想:废液中除酚酞、CaCO3及水以外一定含有。
老师问:废液中还可能有什么物质?引发了同学们热烈讨论,下面是大家的发言:
| 学生甲 |
可能有Ca(OH)2、NaOH |
学生丙 |
可能有Ca(OH)2、CaCl2 |
| 学生乙 |
可能有NaOH、Na2CO3 |
学生丁 |
可能有Na2CO3 |
| 学生戊 |
可能有NaOH |
…… |
………… |
【查阅资料】BaCl2 + Na2CO3→ BaCO3↓ + 2NaCl
Na2CO3 +CaCl2→ CaCO3↓ + 2NaCl
【实验验证】 同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
【结论】上述滤液中,还含有,没有。
在实验室中,同学们用下面所示的装置进行实验(图中固定试管的仪器已略去):加热一段时间后,观察到木炭粉的质量明显减少;砖红色的氧化铁粉沫下部出现了一些黑色的固体;澄清石灰水变浑浊,停止加热并冷却到室温.
(1)写出硬质大试管中发生反应的化学方程式:
、
(2)B装置的作用是。
(3)C装置中澄清石灰水变浑浊,此现象说明。
(4)装置中气球的作用是。
化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理。请你参与并回答相关问题。
(1)实验一:表面除锈
甲组:将锈铁器放入适量稀硫酸中,微热。观察到①溶液变成黄色,铁锈逐渐消失。一段时间后,②锈层完全消失,铁器表面有细小气泡产生,③黄色溶液逐渐变为浅绿色。
a)现象①发生的化学反应方程式为:___________,
b)②中铁器表面的气泡是什么气体___;
c)大家对现象③不理解,老师提示大家:金属单质铁和铜都可以将+3价的铁元素转变为+2价铁元素,其中铜发生的反应过程为2FeCl3+Cu→ 2FeCl2 + CuCl2 。
请你根据老师的提示推测产生现象③的原因。(只写出有关反应的化学方程式)
乙组:(1)在锈铜钱中加入适量稀硫酸。观察到①绿色锈层很快消失,同时产生大量气泡,溶液变成蓝色 。②将气体收集,通入澄清石灰水,石灰水变浑浊。由此,小军等同学推断,绿色铜锈层中肯定含有的元素有_________。
(2)实验二:废液回收
废液桶中收集了溶有大量FeSO4、CuSO4的废水,若直接排放到下水道,不仅造成重金属污染而且浪费资源。小组讨论后设计了如下回收硫酸亚铁晶体和铜的实验方案:
请完成下列有关问题:
①金属X是,其加入废水后发生反应的化学方程式为;
利用溶液Y除去铜中杂质,有关反应的化学方程式为。