氮元素能形成多种多样的化合物.请回答:
(1)298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)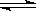 N2O4(g)△H=﹣a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)△H=﹣a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为 L•mol﹣1(精确到0.01);
②下列情况不能用来判断该反应是否处于平衡状态的是 ;
A.混合气体的密度保持不变; B.混合气体的颜色不再变化;C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填“>”、“<”或“=”).
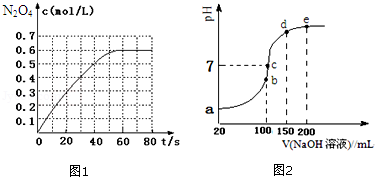
(2)常温条件下,向100mL 0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的).
①a点溶液的pH 1(填“>”“<”或“=”);
②b点溶液中发生水解反应的离子是 ;
③c点溶液中各离子浓度由大到小的排列顺序为 ;
④d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”).
【物质结构与性质】Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 |
Mn |
Fe |
|
| 电离能kJ/mol |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
|
回答下列问题:
(1)Mn元素核外电子的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。其原因是 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①Fe原子或离子易形成配合物的原因是 ,
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是 ,HCN的分子构型为 ,写出一种与 CN-互为等电子体的单质分子的电子式 。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体构成微粒为 。
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。
(17分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g) H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2(填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,氮气的平衡转化率 (填“增大”、“减小”或“不变”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(NH3)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则V正 V逆(填“>”或“<” 或“=”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
①该反应破坏旧化学键吸收的能量 形成新化学键放出的能量,表中数据a d,b f(均选填“>”、“=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
【有机化学基础】迷迭香酸(F)的结构简式为: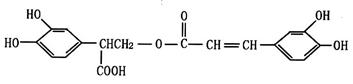
它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下(已知苯环上的羟基很难直接与羧酸发生酯化反应):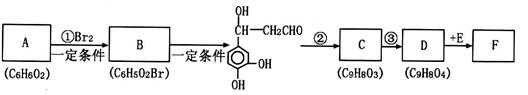
根据题意回答下列问题:
(1)B的结构简式为 ;
反应②的化学方程式为 。
(2)反应③反应类型为 ,选用的试剂为 。
(3)D与E生成F的反应类型为 ,1molF分别与足量的溴水、氢气、NaOH溶液反应,最多可消耗Br2 mol,H2 mol, NaOH mol。
(4)E在一定条件下发生缩聚反应的化学方程式是 。
【物质结构与性质】决定物质性质的重要因素是物质的结构。请回答下列问题: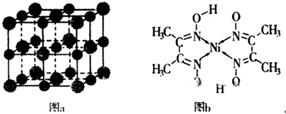
(1)N、O、S、Mg、Al五种元素的第一电离能从大到小的顺序为 。
(2)乙醛(CH3-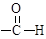 )分子碳原子的杂化方式为 用价层电子对互斥理论推断甲醛中H—C—H的键角 120o(填“>”“<”或“=”)。
)分子碳原子的杂化方式为 用价层电子对互斥理论推断甲醛中H—C—H的键角 120o(填“>”“<”或“=”)。
(3)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。则KCl、CaO、MgO、I2四种离子晶体熔点从高到低的顺序是 。
(4)设MgO晶胞的边长为acm,则MgO的密度是 g·cm-3(只要求列算式。阿伏加德罗常数为NA)。
(5)某配合物的分子结构如图b所示,其分子内含有 (填字母)。
| A.离子键 |
| B.共价键 |
| C.金属键 |
| D.配位键 |
E.氢键
F.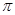 键
键
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
| A.升高温度,正反应速率和逆反应速率都增大,平衡向右移动 |
B.缩小容器容积,平衡右移, H不变 H不变 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低,化学平衡常数增大 |
| D.当气体平均摩尔质量或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+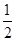 O2(g)=CO(g)
O2(g)=CO(g) H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)=CO2(g) H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)=SO2(g) H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2与CO反应生成S的热化学方程式为: 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时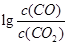 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。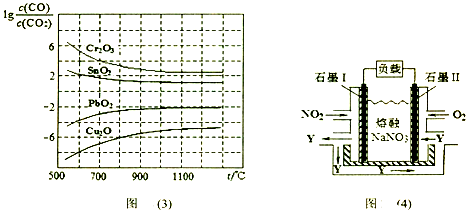
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,石墨II的电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上转移电子 mol。