工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.该法的工艺流程为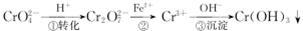
其中第①步存在平衡:2CrO42-(黄色)+2H+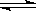 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显____________色.
(2)能说明第①步反应达平衡状态的是________________
a.2v正(Cr2O72-)=v逆(CrO42-)
b.Cr2O72-和CrO42-的浓度相同
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO4•7H2O,
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至____________
方法2:电解法.
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为__________
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)____________,溶液中同时生成的沉淀还有_________。
镁合金是重要的民用和航空材料,镁作为一种强还原剂,还用于钛、镀和铀的生产,氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。
(1)氧化镁的电子式为________。
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式____________________。
(3)从海水中提取金属镁用到的主要化学药品有________________。
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2·6H2O,其流程如下: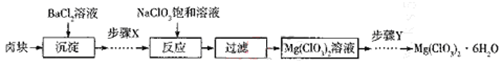
已知:I卤块主要成分为Mg Cl2·6H2O,含有MgSO4、FeCl2等杂质。Ⅱ可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
①加入BaCl2溶液的目的是____________。
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为__________。
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:________________________________________.
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+ I2(g) 2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。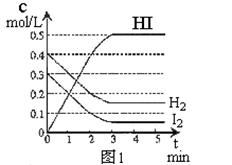
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写增大、减小或不变),HI浓度的变化正确的是 (用图2中a-c的编号回答)。
②若加入I2,则H2浓度的变化正确的是 (用图2中d-f的编号回答)。
根据要求回答下列各题:
(Ⅰ)现有①Na2O ②SO3 ③铁 ④蔗糖 ⑤冰醋酸(纯醋酸晶体) ⑥KNO3晶体 ⑦氢氧化钠溶液等物质,请填空回答(填序号):以上物质在常温下
(1)能导电的是 ;(2)属于非电解质的是 ;
(3)属于电解质的是 ;(4)属于弱电解质的是 。
(Ⅱ)写出下列反应的化学方程式:
(1)有H2O参加的化合反应: ;(2)有H2O生成的分解反应: ;
(3)有HCl生成的置换反应: ;(4)有HCl参加的复分解反应: 。
(Ⅲ)某有机混合物4.6 g完全燃烧,将燃烧后的混合物通入过量的澄清石灰水,石灰水共增重14.2 g,经过滤得到20g沉淀.该有机样品可能是:
| A.C2H6O2 |
| B.CH4和C2H6的混合物 |
| C.C2H6O和C3H8O3的混合物 |
| D.CH4O和C3H8O的混合物 |
根据下面的反应路线及所给信息填空。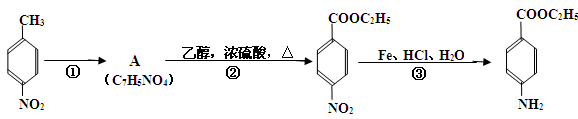
(1)① 的反应条件是: 。② 的反应类型是: 。(苯佐卡因)
(2)反应②的化学方程式: 。
(3)苯佐卡因有多种同分异构体,其中—NH2直接连在苯环上,分子结构中含有-COOR
官能团,且苯环上的一氯取代物只有两种的同分异构体共有六种,除苯佐卡因外,其中两种的结构简式是:
则剩余三种同分异构体的结构简式为: 、 、 。
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能的大小顺序是 (填元素符号),e的价层电子轨道示意图为 。
(2)c的氢化物与d的氢化物的沸点大小顺序是 ;(填化学式)原因是
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;以上元素形成的分子中既含有极性共价键,又含有非极性共价键的化合物是 、 (填化学式,写出两种)。
(4)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸 ;(填化学式)酸根呈三角锥结构的酸是 。(填化学式)
(5) e和c形成的一种离子化合物的晶体晶胞结构如图1,则e离子的电荷为 ;其中c离子的配位数是 ;若已知该晶胞的边长为a pm,阿伏伽德罗常数为NA,则该晶胞的密度为 g/cm3.