按如图所示装置进行铁和水蒸气反应的实验。
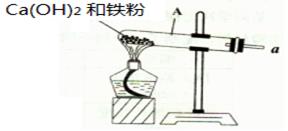
已知:铁与水蒸气反应生成产物有磁性氧化物及可燃性气体。
(1)写出试管A中发生反应的化学方程: ,
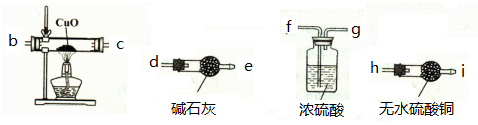
(2)为检验铁与水蒸气反应生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a- ,描述能证明气体产物的实验现象 ;
(3)待试管A冷却后,取少量其中的固体物质进行如下实验:
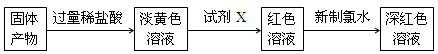
①试剂X的化学式 ;
②用离子方程式表示加入新制氯水后溶液红色加深的原因 ;
③若在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色的原因进行探究。
I.提出假设:
假设1:溶液中的SCN-被氧化;
假设2:溶液中的Fe3+被氧化;
假设3: 。
II.设计方案:请对所提出的假设2进行验证,写出实验方案。
III.方案实施(略)。
(16分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,
请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2="2LiH" Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TIO2 ) , TiO2常通过两种方法可制得 Ti。
其中, 2H2SO4+ FeTiO3 = TiOSO4+ FeSO4+ 2H2O 。回答下列问题。
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH =Na2SiO3 + H2O 和
(2)滤液①中的溶质主要是 FeSO4,检验其中Fe2+的方法是:.
(3)从 TiOSO4→H2TiO3需要加热,则加热的目的是:。
(4)电解 TiO2来获得 Ti 是以 TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为:.
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应 TIO2(s) + 2C12(g) TICl4(l) +O2(g)顺利进行的原因是:
TICl4(l) +O2(g)顺利进行的原因是:
某研究性学习小组利用如图所示装置完成有关实验。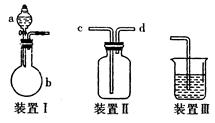
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入。装置Ⅱ从管口进气可作为氨气的收集装置。
【实验二】收集NO
(2)利用装置Ⅱ可收集NO,试简述操作方法:。
【实验三】比较硫、碳、硅三种元素的非金属性强弱
(3)设计实验,完成下列表格(可以不填满,也可以再加行)
| 装置序号 |
仪器中所加物质名称 |
现象 |
某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
| ① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
Fe2+具有还原性 |
|
| ② |
在FeCl2溶液中加入锌片 |
 |
Zn+Fe2+=Zn2++Fe |
|
| ③ |
在FeCl3溶液中加入足量铁粉 |
Fe+2Fe3+=3 Fe2+ |
Fe3+具有氧化性 |
|
| ④ |
 |
Fe3+具有氧化性 |
实验结论:。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:。(填序号)
| A.Cl2 | B.Na | C.Na+ | D.Cl- E.SO2 F.NO2 |
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化。
实验室制配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯②100 mL量筒
③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)⑦滴定管
(1)配制时,必须使用的仪器有______ ______(填代号),还缺少的仪器是__
_。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为____________。