太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VI A族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 (用元素符号表示)。SeO3分子的立体构型为 。
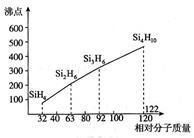
(3)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。
(4)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(5)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由小到大的顺序是(填序号)。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由小到大的顺序是(填序号)。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合后pH=10,则a:b=
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有_____种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,基态Ga原子的电子排布式为______。
(3)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为_______________________________。(用元素符号表示)
(4)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,该元素价电子排布图________,在周期表中的位置________,属于________区。
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色迅速变为灰绿色,最终转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各物质的化学式为:A、B、C、D。
(2)现象②中所发生的反应的化学方程式为:
、。
(3)现象③中所发生反应的离子方程式为:
、。
Ⅰ.近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,长伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+___K2Cr2O7+__H2SO4(稀)→___CO2↑+__K2SO4+Cr2(SO4)3+__ ___
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂______,还原剂______。
(3)硫酸在上述反应中表现出的性质是____________(填选项编号)。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
上述反应若产生11克气体物质,则转移电子的数目___________。
Ⅱ.X元素的原子核外有2个电子层,其中L层有5个电子,该元素在周期表中的位置为________,最高价氧化物的化学式为________,该元素的氢化物和最高价氧化物对应水化物反应的化学方程式为________________________________.
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
请回答下列问题:
(1)写出B中含氧官能团的名称_____________。
(2)既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有___________(用A、B、C、D填空)。
(3)按下图,C经一步反应可生成E,E是B的同分异构体,则反应①属于_________反应(填反应类型名称)。
(4)同时符合下列两项要求的D的同分异构体有4种:
①化合物是1,2-二取代苯;
②苯环上的两个取代基分别为羟基和含有-COO-结构的基团
其中两种(G和H)结构简式如下图所示,请补充另外两种。 __________________、_________________。
__________________、_________________。
(5)写出H与足量NaOH溶液共热反应的化学方程式。