(1)下列有关说法正确的是
A.可用石灰水区分Na2CO3与NaHCO3溶液;
B.HClO4的酸性强于H2SO3,所以非金属性:Cl﹥S;
C.配制0.2 mol·L-1的Na2CO3溶液480mL,需称量10.6g Na2CO3固体;
D.金属钠着火时,可用泡沫灭火器来灭火;
E.强酸可以制弱酸,弱酸通过化学反应一定不能生成强酸;
F.过量的Zn和浓硫酸反应,生成标准状况下气体22.4L,转移电子一定是2mol;
G.SO2使品红溶液褪色和使KMnO4溶液褪色都体现了其漂白性。
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
①溶液中存在的离子是 ;
②写出溶液中加入过量的稀硫酸反应的离子方程式____________________;
③向原溶液中滴加足量NaOH溶液后,过滤洗涤灼烧,最终得到固体质量为 g。
(3)磷的一种化合物叫亚磷酸(H3PO3)。已知:
Ⅰ、0.1 mol/L H3PO3溶液的pH = 1.7;
Ⅱ、H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
Ⅲ、H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是 。
A.②④⑥ B.②③⑥ C.①④⑤ D.②③⑤
写出H3PO3与过量NaOH溶液反应的离子方程式 。
虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
① KMnO4 + KF + H 2O2 + HF → K2Mn F6 + ____________ + H2O
2O2 + HF → K2Mn F6 + ____________ + H2O
② SbCl5 + HF → SbF5 + ____________
③ 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为______________,为什么填这一物质,试用氧化还原反应理论解释_______________________________________。
(2)完成反应②:_______________________________________________ 。
。 (3)反应③中的氧化剂为________________,被氧化的元素为________________。
(3)反应③中的氧化剂为________________,被氧化的元素为________________。
(4)配平反应①,并标出电子转移的方向和数目。(将答案写在下面空格上)
________________________________________________________。
某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L,x与y的关系如下图所示.
mol/L,x与y的关系如下图所示.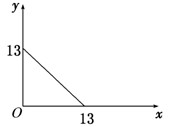
请回答下列问题:
(1)此温度时,水的离子积Kw为 ,则该温度t 25℃(填“>”“<”“=”).
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L
与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小.
①若所得混合液为中性,则a∶b= ;此溶液中各种离子的浓度由大到小排列顺序是 .
②若所得混合液的pH=2,则a∶b= ;此溶液中各种离子的浓度由大到小排列顺序是 .
下图为常温下向25mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液过程中溶液pH的变化曲线。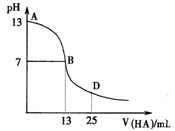
回答下列问题:
(1)上图能确定MOH为(“强”或“弱”)碱,
理由是。
(2)上图能确定HA为(“强”或“弱”)酸,
理由是。
(3)在D点时,溶液中c(A-)+c(HA)2c(M+)。(填“>”、“<”或“=”)
在100℃和200kPa的条件下,反应aA(g) bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
| 压强(kPa) |
200 |
500 |
1000 |
| B的浓度(mol/L) |
0.04 |
0.1 |
0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡移动(填“正向”或“逆向”或“不”),理由是。
(2)压强从500kPa增加到1000kPa时,平衡移动(填“正向”或“逆向”或“不”),其原因可能为。
把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到 联氨(N2H4)。
联氨(N2H4)。
(1)写出上述反应的化学方程式:________ __________
(2)联氨是一种可燃性液体,可用作火箭燃料。已知32.0g N2H4和H2O2反应生成氮气和水(气态),放出热量642kJ,该反应的热化学方程式是:
____________________________________________
(3)联氨的水溶液显弱碱性,用离子方程式表示其显弱碱性的原因:
_______________________________________________
(4)联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。联氨—空气燃料电池放电生成N2和H2O,其电极反应式是:正极________________________;负极_____________________。