乙苯催化脱氢制苯乙烯反应:
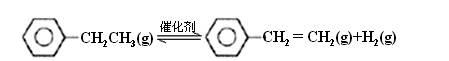
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=____________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和 水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
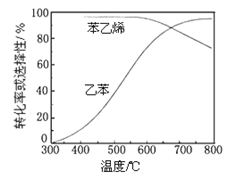
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实______________。
②控制反应温度为600℃的理由是 ____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有__________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平 衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W在元素周期表中的位置是。
(2)Z的原子结构示意图为。
(3)下列选项中,能证明元素非金属性X强于W的是。
| A.原子序数:X>W |
| B.最低化合价:X>W |
| C.最简单氢化物的稳定性:X>W |
| D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如下图所示的转化:
其中化合物D是一种白色沉淀,则B中溶质的化学式为;
C转化生成D的离子方程式为。
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n ,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH—) = mol·L—1 (填计算数值,已知:T℃,Ksp[Y(OH) n]=4.0×l0-12)。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
Ⅰ、步骤②需加入的试剂A是(填化学式);
Ⅱ、步骤③通入的气体B是(填化学式),写出该反应的离子方程式:
分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是。
(3)该反应的氧化剂与还原剂的质量比是。
(4)当消耗0.3 mol S时,则转移的电子数是。
已知下列反应的反应热为
①CH3COOH(l)+2O2(g) = 2CO2(g)+2H2O(l)ΔH1=-870.3 kJ/mol
②H2(g)+ O2(g) = H2O(l)ΔH2=-285.8 kJ/mol
O2(g) = H2O(l)ΔH2=-285.8 kJ/mol
(1)已知1.2 g固体C充分燃烧生成CO2放出热量为39.35 kJ,请写出C的燃烧热化学方程式(碳的燃烧热用ΔH3表示):;
(2)计算反应:2C(s)+2H2(g)+O2(g) = CH3COOH(l)的反应热ΔH。(要有计算过程)
某温度下,将4.0 mol的HI气体充入1 L已经抽空的固定容积的密闭容器中,发生如下反应:2HI(g) H2(g)+I2(g) ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
H2(g)+I2(g) ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n /mol |
0 |
40 |
80 |
120 |
| n(HI) |
4.0 |
2.8 |
b |
c |
| n(H2) |
0 |
a |
1.0 |
1.0 |
(1)a =,c =;
(2)计算在该温度时此反应的平衡常数K =;
(3)保持温度不变,120 s时再通入2.0 mol的H2。当再次达到平衡时,HI的平衡转化率是多少?(本小题要有适当的解题过程)