ClO2与Cl2的氧化性相近,常温下均为气体,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
(1)仪器C的名称是:___________。安装F中导管时,应选用图2中的:___________。(填“a”或“b”)
(2)打开B的活塞,A中氯酸钠和稀盐酸混和产生Cl2和ClO2,写出反应化学方程式:___________;为使ClO2在D中被稳定剂充分吸收,可采取的措施是:___________。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是:_________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为:___________,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是:______________。
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂的原因是 _____________________。
单晶硅是信息产业中重要的基础材料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
| 升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?_________(填 “是”或“否”),请说明理由__________。
②某同学称取5.000g残留物后,所处理后在容量中瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
(14分)(NH4)2Fe(SO4)2比FeSO4稳定,其标准溶液是定量实验中的常用试剂。
(1) 实验室用(NH4)2Fe(SO4)2固体配制一定浓度的(NH4)2Fe(SO4)2标准溶液。
①配制溶液时,需要使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的(填字母代号)
②若要配制0.100 mol·L-1的(NH4)2Fe(SO4)2标准溶液250ml,需称取(NH4)2Fe(SO4)2g
③若在配制过程中,烧杯中的(NH4)2Fe(SO4)2溶液有少量溅出,则所得溶液浓度;若在定容时,俯视液面,则所得溶液浓度。(填“偏高”、“偏低”、“无影响”)
(2)能电离出两种阳离子的盐称为复盐,下列物质中属于复盐的有。
a.KAl(SO4)2b.KAlO2c.NH4Al(SO4)2 d.[Ag(NH3)2]NO3
(3)(NH4)2Fe(SO4)2溶液呈酸性,试用离子方程式解释其原因:
;。
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。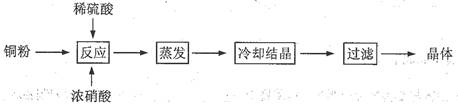
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:、。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H2SO4 + __________→ __CuSO4 +_______________
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
相对分子质量:CuSO4:160 H2O:18
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO4·5H2O的质量分数为。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是
则a g该试样中含CuSO4·5H2O的质量为g (用含b的代数式表示)。
[相对原子质量:H-1 O-16 S-32 Ba-137]
某研究性小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱。
[提出假设]
假设1:Fe2+的还原性比I-强
假设2:I-的还原性比Fe2+强
假设1:一样强
[验证假设]
(1)设计如下几种装置进行实验:
实验必须的装置是A→_______________(按Cl2气流方向的顺序填写)
(2)实验开始后,控制通入少量Cl2,通过观察混合溶液颜色的变化_________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论:
| 实验步骤 |
预期现象和结论 |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加__________溶液 往B中滴加__________溶液 |
①若_______________________________ ________________________,则假设1成立 ②若____________________________ ________________________,则假设2成立 ③若______________________________ ______________________,则假设3成立 |
(4)为了实验成功,必须控制各物质的用量。该小组称取1.52 g FeSO4,同时称取1.66g KI固体,溶于水中。为了验证上述假设,通入的Cl2体积最多不能超过__________L(标准状况)。[相对分子质量:FeSO4 :152 KI :166 ]
[思考与交流]
(5)有同学质疑,上述实验只能验证Cl2分别与Fe2+和I-反应的速率大小,并不能证明Fe2+和I-的还原性强弱。于是提出另一方案:往KI溶液中滴入__________溶液,如果能发生反应,即可证明和I-的还原性强于Fe2+。该反应的离子方程式为:____________________
下图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2的还原性并检验H2的氧化产物,仪器连接顺序为:A→C→B
→B→D时,两次使用B装置,其中所盛的药品依次是、
(写化学式);D装置的作用是
。
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有、
。(要求:写出的两种方法原理不同)
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3。能产生大量NH3的原因是:
a;b;c。
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:A→→→(填正确序号的字母)此时在其中的一个装置中可能会出现大量红棕色气体,该装置是(用字母表示);用化学方程式解释红棕色气体产生的原因:、
。