早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2) 基态Fe原子有 个未成对电子,Fe3+的电子排布式为 。可用硫氰化钾检验Fe3+,形成的配合物的颜色为 。
(3) 新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O,乙醛中碳原子的杂化轨道类型为 ,1mol乙醛分子中含有的σ键的数目为 。乙酸的沸点明显高于乙醛,其主要原因是 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g·cm-3(不必计算出结果)
“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO。
(1)Ca的原子结构示意图为。其最高价氧化物对应水化物的碱性比Mg(OH)2(填“强”或“弱”)。
(2)Ca与非金属性最强的元素A形成化合物D,用电子式表示D的形成过程:。
(3)配平用“金属钙线”脱氧脱磷的方程式:
(4)将“金属钙线”溶于稀盐酸后,滴加少量双氧水后再滴加KSCN溶液呈红色,金属M为(填化学式), 其中滴加双氧水发生的离子方程式是。
(5)取3.2 g“金属钙线”试样,与水充分反应生成448 mL H2(标准状况),在所得溶液中通入适量CO2,最多能得到CaCO3g。
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B,C,指出D在周期表中的位置。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为(用化学式表示)。
(3)写出淡黄色固体E的电子式,其中含有的化学键为。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为。
如图中,A、B、C、D、E是单质,F、G、H、I是B、C、D、E分别和A形成的化合物。已知:①G、H的化学式为“X2Y3”形式,F的化学式为“XY”形式;②I是一种常见的气体,能使澄清石灰水变浑浊,固态I用于人工降雨, E可以在I中燃烧,发生置换反应;③F中的A元素的质量分数为40%。回答问题: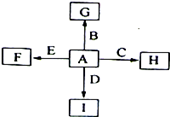
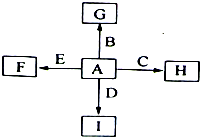
(1)I和E反应的化学方程式为:。
(2)C既能与盐酸反应,又能与氢氧化钠溶液反应。C和A形成的化合物H与氢氧化钠溶液反应的离子方程式为:。电解H可以制取C, 反应的化学方程式为:。
(3)G是一种红棕色粉末,向一定量的G中加入足量硫酸,反应的化学方程式为:。向反应后的溶液中加入足量铁粉,反应的离子方程式为:。
(4)G与盐酸反应的离子方程式为:。得到的溶液中加入铜粉,反应的离子方程式为:。1.6gG溶于盐酸,得到的溶液与铜粉完全反应,至少需铜粉g。
化学知识在各个领域应用广泛。如:
(1)2003年10月15日,我国成为世界上第三个将人送入太空的国家,这次载人航天发射使用
的“长征”二号火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮为氧化剂,燃烧主要产生CO2、N2等气体,放出的巨大能量把火箭送入太空。反应的化学方程式为:。
(2)管道工人曾经用浓氨水检验氯气管道。如果氯气管道某处漏气,会出现白烟现象。氨与氯
气反应的化学方程式为:。出现白烟现象的化学方程式为:。
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。工业生产ClO2过程是将食盐
水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。反应的化学方程式为:。
(4)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的。这一过程中发生反应的化学方
程式为:。
(5)维生素C在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+。这说明维生素C具有。(填“氧化性”或“还原性”)
我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时会产生N2、CO2等。
(1)爆炸时的化学方程式为:。
(2)在黑火药爆炸的反应中硫作氧化剂,在一些反应中硫也可以作还原剂,写出一个硫在反应中作还原剂的化学方程式:。
(3)氮气在放电条件下与氧气反应的化学方程式:。
(4)一氧化氮、二氧化氮都是氮氧化物。一氧化氮在常温下很容易与空气中的氧气化合,化学方程式为:。二氧化氮能与水反应,化学方程式为:。