W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻.已知W元素的氢化物与Z元素的氢化物反应只生成一种盐a;X,Y位于同一族,它们能组成YX2,YX3两种常见化合物.请回答下列问题:
(1)X元素位于周期表的位置为_____________________________________
(2)X,Y,Z三种元素形成的单质中,氧化性最弱的是___________(填化学式).
(3)a溶液的pH__________7(填“>”、“<”或“=”),用离子方程式解释为:__________.
(4)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为__________.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为______________________
(5)工业上用氧化WH3法制取WO,该反应的热化学方程式为:
4WH3(g)+5O2(g)=4WO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知W2(g)+O2(g)=2WO(g) △H="+180" kJ·mol-1,则WH3与氧气反应产生两种无污染物质的热化学方程式为 。
同温同压下,等体积的CO和CO2的物质的量之比________,质量比________,密度比________,所含氧元素的质量比________。
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成: Al2O3+N2+3C==2AlN+3CO
(1)在这个反应中,氧化剂是_____________, 还原剂是____________
(2)标出该反应中电子转移的方向和数目_________________________________
碘元素的一种核素12553I可用于治疗肿瘤。该核素的质子数为_____________,中子数为__________,质量数为__________,核外电子数为___________.
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 。
(3)由N2O和NO反应生成N2和NO2的能量变化如下图所示, 若生成1molN2,计算该过程的△H= kJ·mol-1。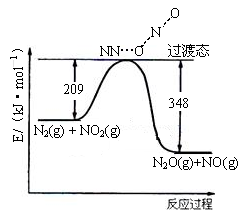
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
① 一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L,b mol/L,则SO2 起始物质的量浓度为_________mol/L;生成SO3的化学反应速率为__________mol/(L • min)。
②工业制硫酸,尾气SO2用__________吸收。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示: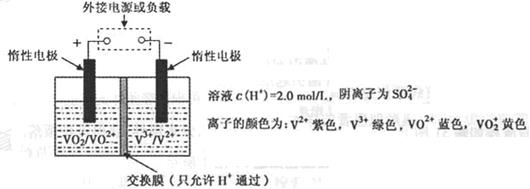
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为 。