2015年“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。

(1)请你帮助它走出迷宫:(请用图中物质前的序号连接起来表示所走的路线)______________。
(2)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有______个,属于氧化还原反应的有____个。其中能“吃掉”盐酸的盐是__________(填物质名称),写出该反应的离子方程式_______________;
(3)在不能与盐酸反应的物质中,属于电解质的是__________ (填写物质序号)。
4种相邻的主族短周期元素的相对位置如表,元素
的原子核外电子数是
的2倍,
的氧化物具有两性。回答下列问题:
(1)元素
在周期表中的位置是第周期、第族,其单质可采用电解熔融的方法制备。
(2)
、
、
三种元素最高价氧化物的水化物中,酸性最强的是,碱性最强的是.(填化学式)
(3)气体分子
的电子式为,
称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是。
是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度
的催化下,探究
浓度对
分解反应速率的影响。限选试剂与仪器:30%
、0.1
、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验
分解反应方程式并标明电子转移的方向和数目:
②设计实验方案:在不同
浓度下,测定(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。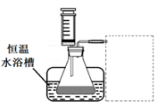
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用图
和
中的信息,按图
装置(连能的
、
瓶中已充有
气体)进行实验。可观察到
瓶中气体颜色比
瓶中的(填"深"或"浅"),其原因是。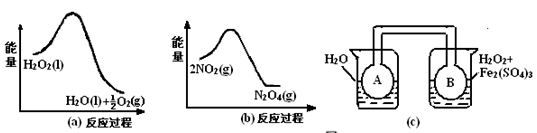
石墨在材料领域有重要应用。某初级石墨中含
(7.8%)、
(5.1%)、
(3.1%)和
(0.5%)等杂质。设计的提纯和综合应用工艺如下:
(注:
的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入
前,需通一段时间的
,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100
初级石墨最多可获得
的质量为
。
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。
用
代替
与燃料
反应,既可以提高燃烧效率,又能得到高纯
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①
②
③
(1)反应
的
(用
表示)。
(2)反应①~③的平衡常数的对数
随反应温度
的变化曲线见图18.结合各反应的
,归纳
曲线变化规律:
a)
b)
(3)向盛有
的真空恒容容器中充入
,反应①于900 ºC达到平衡,
平衡(
)=8.0×10-5
,计算
的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的
,可在初始燃料中适量加入。
(5)以反应①中生成的
为原料,在一定条件下经原子利用率100%的高温反应,可再生成
,该反应的化学方程式为;在一定条件下
可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为。
不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物I的说法,正确的是
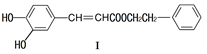
| A. | 与 溶液可能显紫色 |
| B. | 可能发生酯化反应和银镜反应 |
| C. | 能与溴发生取代和加成反应 |
| D. | 1 化合物I最多与2 反应 |
(2)反应①的一种由烯烃直接制备不饱和酯的新方法
化合物II的分子式为。1
化合物II能与
恰好反应生成饱和烃类化合物。
(3)化合物II可由芳香族化合物III或IV分别通过消去反应获得。但只有III能与
反应产生
。III的结构简式为(写1种);由IV生成II的反应条件为。
(4)聚合物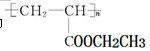 可用于制备涂料。其单体的结构简式为。利用类似反应①的方法仅以乙烯为有机原料合成该单体,涉及的反应方程式为。
可用于制备涂料。其单体的结构简式为。利用类似反应①的方法仅以乙烯为有机原料合成该单体,涉及的反应方程式为。