某试液中只可能含有K+、NH4+、Fe2+、Fe3+、Cl-、SO42-、NO3-、AlO2- 中的若干种离子,离子浓度均为0.1 mol·L-1,某同学进行了如下实验:
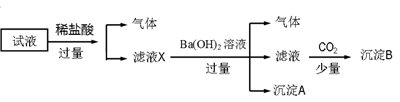
下列说法正确的是( )
| A.无法确定原试液中是否含有Fe3+、K+ |
| B.滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ |
| C.无法确定沉淀B的成分 |
| D.原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42- |
下列各组离子在强碱性溶液中,可以大量共存的是( )
A.K+、Na+、HSO 、Cl- 、Cl- |
B.Na+、Ba2+、[Al(OH)4]-、NO |
C.NH 、K+、Cl-、NO 、K+、Cl-、NO |
| D.Fe2+、Na+、ClO-、S2- |
对于可逆反应N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),下列说法中正确的是( )
2NH3(g)(正反应为放热反应),下列说法中正确的是( )
| A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,N2的浓度比原平衡的小 |
| B.达到平衡后,升高温度,既加快了正、逆反应速率,又提高了NH3的产率 |
| C.达到平衡后,缩小容器体积,既有利于加快正、逆反应速率,又有利用提高氢气的转化率 |
| D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,而逆反应速率减小了 |
在某密闭容器中,可逆反应:A(g)+B(g) xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
| A.p3>p4,y轴表示A的转化率 |
| B.p3>p4,y轴表示B的质量分数 |
| C.p3>p4,y轴表示C的质量分数 |
| D.p3>p4,y轴表示混合气体的平均相对分子质量 |
下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
T ℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )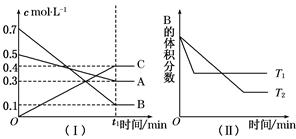
A.在(t1+10) min时,其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10) min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T ℃时,在相同容器中,若由0.3 mol·L-1A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大