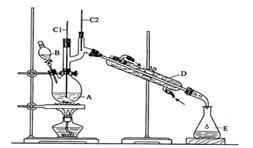
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
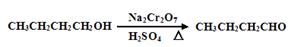
反应物和产物的相关数据列表如下:
| |
沸点/℃ |
密度/g·cm-3 |
水中溶解性 |
| 正丁醇 |
117.2 |
0.8109 |
微溶 |
| 正丁醛 |
75.7 |
0.8017 |
微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由。
(2)加入沸石的作用是_______________。
(3)上述装置图中,B仪器的名称是____________,D仪器的名称是____________。
(4)分液漏斗使用前必须进行的操作是_______________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在_________层(填“上”或“下”)。
(6)本实验中,正丁醛的产率为____________%。
(12分)含有下列离子的五种溶液①Ag+②Mg2+③Fe2+④Al3+⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是________(填离子符号,下同)。
(2)向③中加入NaOH溶液,现象是______________________________,
有关方程式(是离子反应的写离子方程式)为__________________。
(3)加入过量NaOH溶液无沉淀的是_____________。
(4)加入铁粉若溶液质量增重的是_______,若溶液质量减轻的是_______________。
(5)遇KSCN溶液呈红色的是______________。
(6)能用来鉴别Cl-存在的离子是_______________。
(12分)国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
(1)该废液中可能大量存在的一种阴离子是________(选填序号).
| A.SO42- | B.NO3- | C.Cl- | D.CO32- |
(2)检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是________,铝元素发生变化的离子方程式是______________________.
(3)为了回收废液中的金属银,某同学设计了如下方案: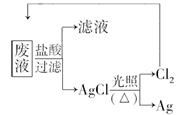
若依该方案获得银108 g,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气________L.
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。
根据卤代烃的相关性质,回答下列问题:
I.(1)由异丙苯( )制备对溴异丙苯需要的反应物(写名称)是,反应条件是。
)制备对溴异丙苯需要的反应物(写名称)是,反应条件是。
(2)α﹣甲基苯乙烯( )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)
II.有机物M是一种重要的化工原料,已知M分子式为C7H14O2,1mol M最多消耗46g金属钠。M 可通过下列路线合成(某些反应的反应物和反应条件未列出):
(1)按要求写出结构简式:AC
(2)写出反应④的化学方程式:④;
(3)⑥的反应类型是___________;
(4)写出M中所含官能团的名称。
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4﹣、HPO42﹣、和PO43﹣四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线: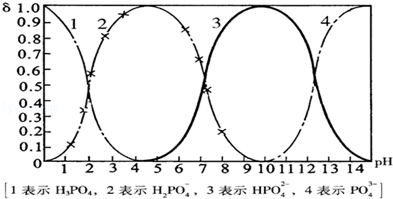
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为.当pH=7时,溶液中主要存在的阴离子(OH﹣离子除外)是.
(3)从图中推断NaH2PO4溶液呈性(填“酸”、“碱”、或“中”),其原因是.
(4)在Na3PO4溶液中,c(Na+)/c(PO43-)3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是。
(1)为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2﹣。
以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式,已知一个电子的电量是1.602×10﹣19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成
NaOHg。
(2)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJ•mol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为:。
(3)某温度时,向AgNO3溶液中加入K2CrO4溶液会生成Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.
①该温度下,下列说法正确的是.
| A.Ag2CrO4的溶度积常数(Ksp)为1×10﹣8 |
| B.含有大量CrO42-的溶液中一定不存在Ag+ |
| C.a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| D.0.02mol•L﹣1的AgNO3溶液与0.02mol•L﹣1的Na2CrO4溶液等体积混合会生成沉淀 |
②若常温下Ksp[Cr(OH)3]=10﹣32,要使c(Cr3+)降至10﹣5mol•L﹣1,溶液的pH应调至.