水溶液中的行为是中学化学的重要内容。
(1)25 ℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为_______________。
(2)25 ℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释) 。
(3)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
25 ℃时,将浓度相同的四种盐溶液:① NaCN ② NaClO ③ Na2CO3 ④ NaHCO3,按pH由大到小的顺序排列 (填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为 。
(4)25 ℃时,将n mol·L-1的氨水与0.2mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______________性(填“酸”、“碱”或“中”), NH3·H2O的电离常数Kb=_____________(用含n的代数式表示)。
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g).下图表示该反应进行过程中的能量变化.
CH3OH(g).下图表示该反应进行过程中的能量变化.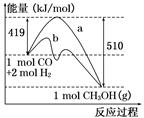
(1)曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时的能量变化,该反应是______(填“吸热”或“放热”)反应.写出该反应的热化学方程式_______________.
(2)选择适宜的催化剂________(填“能”或“不能”)改变该反应的反应热.
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是___________________.
(2)13 g C2H2(g)完全燃烧生成CO2和H2O(l)时放出650 kJ热量,则表示C2H2(g)燃烧热的热化学方程式为_______________________________________________________.
磷单质及其化合物的有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)===3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)===6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)===P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2 (s)+CaO(s)===CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=________。
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见下图)之间脱去两个水分子的产物,其结构式为______。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为________。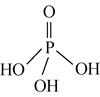
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中磷元素的化合价为________。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)______Ni2++________H2PO2-+______________===____________Ni+________H2PO+________
(b)6H2PO2-+2H+===2P+4H2PO3-+3H2↑
请配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:________;原理上的相同点:________;化学镀的优点:________。
近年来,太湖蓝藻暴发,造成无锡市自来水水源地水质严重恶化。这再次敲响了我国水危机的警钟。太湖流域某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe3+、Ba2+、K+、OH-、Cl-、CO32-、SO42-。为了进一步确认,取样进行实验检测:
①取污水仔细观察,呈无色、透明、均一状态。
②向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
③用pH试纸测定污水的pH,试纸显深蓝色。
(1)由此可知,该污水中肯定含有的离子是__________,肯定没有的离子是__________,可能含有的离子是________。
(2)如何通过实验进一步确定溶液中可能存在的离子?
物质A~E都是中学化学中常见的物质,它们可以发生如下图所示的反应:
(1)写出相应物质的名称和类别:
| A |
B |
C |
D |
E |
|
| 名称 |
|||||
| 类别 |
(2)在以上反应中(用序号填空):
属于氧化还原反应的是________,属于置换反应的是________,属于分解反应的是________,属于化合反应的是________,属于复分解反应的是________,属于离子反应的是________。
(3)写出反应③的离子方程式:___________________________。