已知:2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ/mol,下列说法错误的是( )
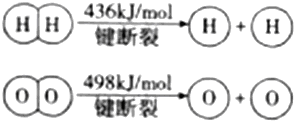
| A.该反应原理可用于设计氢氧燃料电池 |
| B.破坏1mol H-O键需要的能量是926.8kJ |
C.H2O(g)=H2(g)+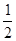 O2(g)△H=+241.8kJ/mol O2(g)△H=+241.8kJ/mol |
| D.H2(g)中的H-H键比H2O(g)中的H-O键能小 |
限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式:
2H++SO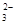 ===H2O+SO2↑的化学方程式个数有
===H2O+SO2↑的化学方程式个数有
| A.4 | B.5 | C.8 | D.12 |
下列实验操作不能达到预期实验目的的是
| 实验目的 |
实验操作 |
|
| A |
鉴别Na2SO4和Na2SO3 |
加入HCl和BaCl2溶液 |
| B |
比较Fe和Cu的金属活动性 |
分别加入浓硝酸 |
| C |
比较H2O和乙醇中羟基氢的活泼性 |
分别加入少量Na |
| D |
比较I2在H2O和CCl4中的溶解度 |
向I2水中加入CCl4,振荡 |
下列离子方程式中,正确的是
| A.碳酸钡与甲酸反应: BaCO3+2 H+ = Ba2++ CO2↑+H2O |
| B.足量NaOH溶液与NH4HS溶液反应:OH-+NH4+=NH3∙H2O |
| C.用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓ |
| D.硫酸型酸雨放置一段时间溶液的pH下降:2H2SO3+O2=4H+ + 2SO42- |
已知NA代表阿伏加德罗常数,下列说法正确的是
| A.34 g H2O2中含有的阴离子数为NA |
| B.标准状况下,22.4 L O2 作氧化剂时转移电子数一定为4NA |
C.T ℃时,1 L pH=6纯水中,含10-6NA个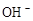 |
| D.10 L 0.1 mol·L-1的Na2CO3溶液中,Na+、CO32-总数为3 NA |
某无色溶液中滴入石蕊试液显红色,该溶液中可以大量共存的是
| A.Na+、Cl-、Mg2+、ClO- | B.Fe2+、NH4+、Cl-、NO3一 |
| C.Na+、HCO3-、AlO2一、K+ | D.Na+、Ba2+、Cl-、NO3一 |