某学习小组利用下图所示装置制备氨气,并探究氨气的性质(部分仪器略去)。
请回答下列问题:
(1)写出以A装置制备氨气的化学方程式:__________________
(2)用B装置收集氨气时,氨气的进气口是__________(填“a”或“b”)。
(3)B装置中烧瓶已收集满氨气,若要使之形成喷泉,操作方法是__________。若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_________(填序号)。
(5)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式:_________。
请利用下列装置及试剂组装一套装置。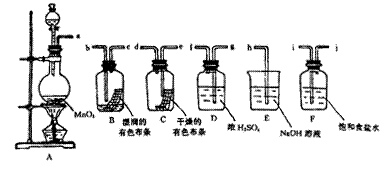
其流程是,先制取纯净干燥的Cl2 (不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(1)按气体从左向右流向将各装置依次连接起来(填字母序号):
a接 ____ _ _____接h 。
(2)烧瓶中发生反应的化学方程式是。
(3)E装置的作用是,F装置的作用是。
(4)C瓶中的现象是,B瓶中的现象是。以上事实说明起漂白作用的物质是。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下: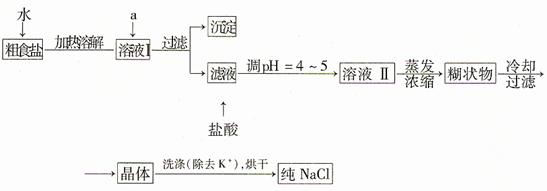
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液 、 75%乙醇、四氯化碳;欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42—离子,选出a所代表的试剂,按滴加顺序依次是(只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒、托盘天平、烧杯还需要(填仪器名称);若定容时仰视刻度线,则所配溶液的浓度(填“偏大”、“偏小”或“无影响”)。
(3)在电解饱和食盐水的实验中,若收集的H2为3.36 L(在标准状况下),则转移电子的个数为,同样条件下收集的Cl2(填“>”、“=”或“<”)3.36 L。
(4)实验室制备Cl2通常采用二氧化锰与浓盐酸共热来制取,发生反应的离子方程式为:;
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置(填代号)
可选用制备气体的装置:
所选装置中的两个洗气瓶里应依次盛装、(填试剂的名称),请结合化学平衡移动原理解释第一个洗气瓶中试剂选择的理由;尾气用溶液(填化学式)吸收,写出发生反应的离子方程式。
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )
(2)A中常选用的固体反应物为____________;D中应选用的液体为___________ (填化学式)
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________________________,C中广口瓶内产生固体的总化学方程式为。
(5)在第四步中分离NH4Cl晶体的操作是________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3约占5%—8%),请设计一个简单的实验证明所得固体的成分中含有Na+。简要写出操作和现象。
单晶硅是信息产业中重要的基础材料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
| 升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?_________(填 “是”或“否”),请说明理由__________。
②某同学称取5.000g残留物后,所处理后在容量中瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
(14分)(NH4)2Fe(SO4)2比FeSO4稳定,其标准溶液是定量实验中的常用试剂。
(1) 实验室用(NH4)2Fe(SO4)2固体配制一定浓度的(NH4)2Fe(SO4)2标准溶液。
①配制溶液时,需要使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的(填字母代号)
②若要配制0.100 mol·L-1的(NH4)2Fe(SO4)2标准溶液250ml,需称取(NH4)2Fe(SO4)2g
③若在配制过程中,烧杯中的(NH4)2Fe(SO4)2溶液有少量溅出,则所得溶液浓度;若在定容时,俯视液面,则所得溶液浓度。(填“偏高”、“偏低”、“无影响”)
(2)能电离出两种阳离子的盐称为复盐,下列物质中属于复盐的有。
a.KAl(SO4)2b.KAlO2c.NH4Al(SO4)2 d.[Ag(NH3)2]NO3
(3)(NH4)2Fe(SO4)2溶液呈酸性,试用离子方程式解释其原因:
;。