王军同学在阅读课外读物时得知工业上制得的纯碱中常含有一定量的NaHCO 3,于是他从家中取来某纯碱样品,和同学们进行了如下探究活动。
【实验目的】探究该纯碱样品中是否含有NaHCO 3。
【查阅资料】NaHCO 3易溶于水,其水溶液呈碱性,受热易分解生成Na 2CO 3、CO 2和H 2O.NaHCO 3属于 (填"酸"、"碱"或"盐")类物质。
【实验设计】王军同学根据实验目的设计了如下两种方案:
方案1:取样,加适量水溶解,向所得溶液中滴加酚酞溶液,观察现象。
方案2:取样,将其加入如图所示实验装置的试管中,加热,观察装置B中的现象。
王强同学认为方案1不能达到实验目的,你认为他的理由是 。
【进行实验】按方案2进行实验时,观察到装置B内澄清石灰水变浑浊,该反应的化学方程式是 。
【实验结论】上述实验现象说明该纯碱样品中 (填"含有"或"不含有")NaHCO 3。
【讨论交流】李娜同学想利用方案2中的装置来测定该纯碱样品中Na 2CO 3的含量,她提出需要充分吸收反应生成的CO 2,为此,你认为装置B内最好盛装 溶液。
【拓展应用】欲除去Na 2CO 3固体中混有的NaHCO 3,最简便的方法是 。

某兴趣小组的同学在老师的指导下,对一瓶没有塞橡皮塞的氢氧化钙溶液进行探究,请你一起参与.
【提出问题】该氢氧化钙溶液是否全部变质?
【猜想与假设】猜想①:氢氧化钙溶液可能全部变质,变成碳酸钙.
猜想②:氢氧化钙溶液可能部分变质,其成分是 .
【实验探究】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取样于试管中,滴加稀盐酸 |
有 生成 |
原溶液里一定有碳酸钙 |
| (2)另取样于试管中,滴加酚酞试液 |
溶液成红色 |
原溶液一定有 |
【实验结论】综合上述实验(1)、(2),你得出的结论是猜想 成立.
【反思拓展】(1)氢氧化钙露置于空气中容易变质,原因是 (用化学方程式表示).
(2)在分析化学反应的物质成分时,除了考虑生成物外,还需考虑的是 .
测定溶解度有多种方法,下列是测定30℃时硫酸铜溶解度的实验方法。经查找资料,30℃时硫酸铜的溶解度为25g/100gH2O。
一、配置30℃时的硫酸铜饱和溶液:
(1)配置的步骤如图:
取用100mL水,图中称量得到22.2g硫酸铜用于实验,是否合理,请说出理由;并在30℃的水浴中加热硫酸铜溶液一段时间,保证硫酸铜完全溶解,得到饱和溶液。
二、测量一定质量饱和硫酸铜溶液中硫酸铜的质量:
(2)在已配得的30℃时饱和溶液中,迅速取出饱和溶液50g,采用蒸发的方法求得硫酸铜的质量。从饱和溶液中析出蓝色晶体的化学式为(10),得到晶体后还要继续加热,直至固体颜色变为(11)色为止。此操作过程中,用到的仪器除铁架台、酒精灯外,还需(12)。
(3)最后称量得到固体质量为9.8g,经计算得到此时硫酸铜的溶解度为(13)g/100gH2O(精确到0.1g)。实验反思:实验数值比资料中的数据偏小,可能的原因是(14)(写出一条即可);
(4)测量50g饱和硫酸铜溶液中硫酸铜的质量,还可以使用重量法。
实验原理:CuSO4+BaCl2 →CuCl2+BaSO4↓
该实验方法中一定还要用到的实验操作是(15)(填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
为控制大气中“温室效应”(CO2、CH4)气体的排放量,“低碳”正成为人们的共识。
(1)近几十年来大气中二氧化碳含量不断上升的主要原因是。
(2)生活中燃烧等物质的量的碳、一氧化碳、甲烷,最终排放出的二氧化碳的量(选填编号)
| A.一样多 | B.碳多 | C.一氧化碳多 | D.甲烷多 |
(3)CO2常用来做灭火剂,但是遇到特殊物质时,CO2也能支持燃烧,写出镁条在CO2中燃烧的化学方程式,该反应中做还原剂的是。
(4)实验室制取二氧化碳,采用的实验原理用化学方程式表示为;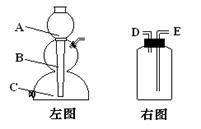
若用左图制取CO2则碳酸钙固体应该放置的位置是,若用右图收集CO2则气体进入的导管口应该是(以上均用图中英文编号填写)。
(5)实验室利用澄清石灰水检验CO2时发生的化学方程式为。
实验室利用H2+CuO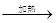 Cu+H2O反应原理(实验装置见下图),测定水分子中氢氧原子的“相对原子质量”比值,实验室中制得的氢气中有少量水蒸气。则有关实验操作说法正确的是
Cu+H2O反应原理(实验装置见下图),测定水分子中氢氧原子的“相对原子质量”比值,实验室中制得的氢气中有少量水蒸气。则有关实验操作说法正确的是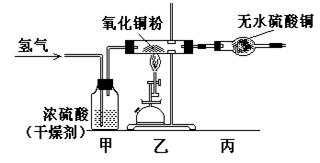
| A.只需要获得氧化铜粉前后的质量差 |
| B.只需要获得无水硫酸铜前后的质量差 |
| C.若没有“甲”装置,所得比值偏大 |
| D.实验中一定要通入足量的氢气将氧化铜完全反应 |
某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).
查阅资料:草酸在浓硫酸存在时加热发生如下反应:
H2C2O4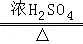 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O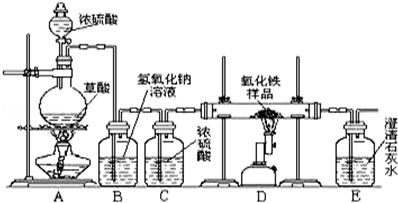
通过讨论,同学们对这套装置有了多种认识.
(1)第一小组同学说:从实验安全和实验操作程序看,首先要 ,实验开始先加热A处,实验结束时,应先停止D处的加热;从环境保护角度分析,此装置存在的明显不足是 ;
(2)第二小组的同学说:其中B装置的作用除去CO2;装置C的作用是 ;用该实验装置可以检验一氧化碳与氧化铁反应的产物,E装置的作用 ;一氧化碳与氧化铁反应的化学方程式为 .