为探究盐酸的化学性质,某化学小组做了如下实验:
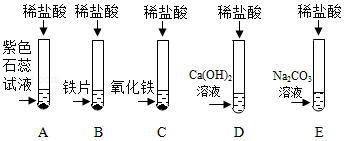
(1)A试管中的实验现象为 ,C试管中所发生反应的化学方程式为 。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。

【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:
猜想四:NaCl、Ca(OH)2和HCl
【进行讨论】经过讨论,同学们一致认为猜想 是错误的。
【设计实验】请完成实验报告。
实验步骤 |
实验现象 |
实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 |
|
猜想二不成立 |
取少量滤液于试管中,滴加 (填名称)。 |
|
猜想三成立 |
【迁移拓展】稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有 。
某兴趣小组同学在实验室将一定量的稀硫酸加入到盛有氢氧化钠溶液的烧杯中,未看到明显的现象.部分同学产生疑问:酸和碱到底能否发生反应?
(1)该小组同学又做了如下实验:
| 实验步骤 |
实验现象 |
实验结论及反应方程式 |
| 向滴有酚酞溶液的稀氢氧化钠溶液的试管中,加入稀硫酸,并振荡 |
观察到溶液由 色变为无色. |
氢氧化钠和硫酸发生了反应.反应的化学方程式为 . |
(2)同学们对(1)实验后溶液中的溶质组成展开探究,做出如下猜想:
小明的猜想是:只有Na2SO4;
小亮的猜想是:有Na2SO4和NaOH;
小丽的猜想是:有Na2SO4和H2SO4;
你认为 的猜想不合理.理由是 .
若要验证余下两种猜想中的一种是正确的,请完成下面的实验方案.
| 实验步骤 |
预期实验现象 |
实验结论 |
| 取(1)实验后溶液少量于试管中,加入 |
的猜想正确 |
(2013陕西)小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成。他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究。
【提出问题】反应后溶液中溶质的成为是什么?
【猜想假设】
猜想①Na2SO4、Na2CO3
猜想②Na2SO4、Na2CO3、NaOH
猜想③Na2SO4、H2SO4、Na2CO3
猜想④Na2SO4、 H2SO4
猜想⑤Na2SO4
上述猜想中,你认为不合理的是猜想__(填序号)。
【实验探究】(1)小鹏取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,据此,他认为猜想⑤是正确的。你认为他的结论是__(填“合理”或“不合理”)的,理由是 。
(2)小明向盛有少量氧化铜粉末的试管中加入适量该溶液,振荡,溶液变蓝。该反应的化学方程式是 。
【实验结论】根据上述实验探究,你认为猜想___(填序号)是正确的。
【拓展应用】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是 (答一点即可)。
【2014年广西省南宁市】某碳酸钾固体样品,可能含有硫酸钾、碳酸钙、硫酸铜、氯化钾、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:
①取少量样品溶于水得到无色溶液,然后滴加过量的氯化钡溶液,出现白色沉淀A,过滤.
②沉淀A中加入过量的稀硝酸,沉淀部分消失并放出气体.往步骤①所得的滤液中加入适量硝酸银溶液和稀硝酸,生成白色沉淀B,过滤.回答下列问题:
(1)白色沉淀B是 ,步骤②中放出的气体是 .
(2)杂质中一定含有 ,一定没有 .
(3)最终所得滤液中含有的阳离子是 .
【2014年四川省广元市】某同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂.因此,他停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行了如下探究,请你和他一起完成探究活动.
【提出问题】溶液中的溶质是什么物质?
【作出猜想】猜想一:溶质只有氯化钙;
猜想二:可能是CaCl2和Ca(OH)2;
猜想三:_________ .
【查阅资料】氯化钙溶液呈中性.
【方案设计】
| 方案 |
方法步骤 |
实验现象 |
实验结论 |
| 方案一 |
取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 |
酚酞不变色 |
猜想一正确 |
| 酚酞变红色 |
猜想二正确 |
||
| 方案二 |
取少量烧杯内的溶液于试管中,逐滴加入_________ 溶液至过量 |
_________ |
猜想三正确 |
【方案评价】该同学与同学们通过讨论认为:
(1)方案一能证明猜想二正确,但不能证明猜想一正确.
(2)方案二可行.但该同学在记录时未记录完整,请你帮他将方案二补充完整.
【方案反思】方案一不能证明猜想一正确的理由是_________ .
【拓展与应用】实验证明猜想三是正确的.要想使溶液中的溶质只有氯化钙,你认为应该进行的实验步骤是_________ .
【结论】在分析化学反应后所得物质成分时,除考虑生成物外还需考虑_________ .
【2014年四川省遂宁市】(8分)某化学兴趣小组学习酸碱中和反应后,对稀盐酸与氢氧化钠溶液混合后的有关问题,进行了如下探究,请你一起参与他们的探究。
【提出问题】氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么?
【作出猜想】
甲同学猜想:溶质有NaCl、HCl、NaOH
乙同学猜想:溶质只有NaCl
丙同学猜想:溶质有NaCl、HCl
你的猜想:溶质有 ① .(填化学式)
乙同学认为甲同学的猜想是错误的,理由是 ② 。
【实验设计及验证】请你将下列实验报告填写完整: