(1)下列关于实验的描述正确的是 (多选,用字母作答)
A.硫在空气中燃烧,发出明亮的蓝紫色火焰,生成无色无味的气体
B.向放置于沸水的白磷中鼓入氧气,白磷燃烧
C.用pH试纸测量氯化钠溶液,得到pH=12
D.两种不同质量分数的食盐水混合,搅拌静置,液体分层
E.在氢气还原氧化铜的实验中,固体颜色由黑色变为红色
(2)请从甲乙两题中任选一个作答,若两题均作答。按甲计分。
甲:粗盐中难溶性杂质的去除 |
乙:配制100g 5%的氯化钠溶液 |
①粗盐的溶解过程中,玻璃棒的作用是 ②过滤需用到的玻璃仪器有 ( 填字母)。 ③加热过程中当蒸发皿中 ,停止加热。 |
①称量时氯化钠应放在托盘天平的 。 ②用 (填一个字母)量取所需的水,倒入盛有氯化钠的烧杯中。 ③把配制好的氯化钠得液装入 中,盖好瓶塞,并贴上标签。 |
②中可供选择的仪器:A.试管 B.烧杯 C.10mL量筒 D.100mL量筒 E.胶头滴管F.漏斗 G.玻璃棒 |
|
利用下列实验来探究CO2气体的制取和性质。
(1)A、B、C三套发生装置都可用于实验室制取CO2气体。
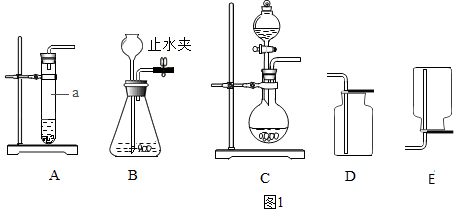
①仪器a的名称是 。
②实验室制取CO2的化学方程式是 ;收集CO2可选用的装置是 (填序号),检验CO2收集满的方法是 。
③利用B装置制取CO2时,反应未停止前关闭止水夹,可观察到的现象是 。
④与A装置相比,利用C装置制取CO2的优点是 。
(2)某化学兴趣小组对CO2的性质进行了探究。实验步骤如下:
步骤1:如图2所示装置的气密性良好(图中a处连接气体压力传感器),甲、乙、丙三个烧瓶的容积均为250mL,分别收集满CO2,三个注射器内各装有85mL液体。
步骤2:三位同学同时迅速将注射器内液体全部注入各自烧瓶中,关闭活塞;一段时间后,同时振荡烧瓶。
步骤3:利用“数字化实验”测定烧瓶内的气压变化,得到如图3所示的烧瓶内压强与时间的关系曲线图,曲线1、2、3分别表示甲、乙、丙三个烧瓶内的气压变化。
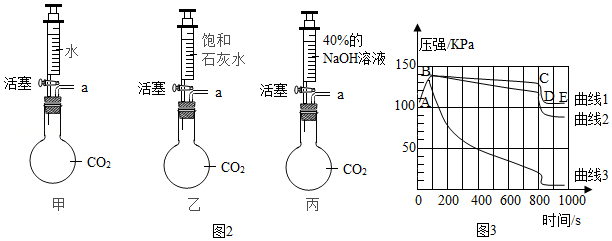
①实验过程中,观察到烧瓶乙中有白色沉淀生成。写出该反应的化学方程式: 。
②曲线1中BC段气压逐渐变小的原因是 ,导致CD段气压快速变小的操作是 。
③对比曲线1与曲线3,能得出的结论是 (填序号)。
a.CO2能溶于水
b.CO2能与水发生反应
c.CO2能与NaOH溶液发生反应
钼是一种重要的金属,用它制成的合金有良好的机械性能,在工农业生产和国防上都有广泛的用途。如图是利用钼矿石(主要成分为MoS 2)制备金属钼的流程图:
信息:MoO 3+3H 2 Mo+3H 2O
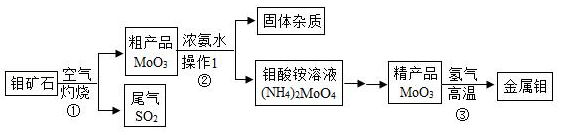
请回答下列问题:
(1)反应①常将钼矿石粉碎,目的是 ;MoO 3中钼元素的化合价为 。
(2)操作Ⅰ的名称是 ;常用NaOH溶液吸收反应①的尾气,化学方程式为 。
(3)制得19.2吨金属钼,理论上至少需含MoO 380%的粗产品多少吨?请写出计算过程。
注:粗产品杂质中不含钼元素
水是生命之源,是“永远值得探究的物质”,人类从未停止过对水的研究。
(1)1766年,英国化学家卡文迪许用锌和稀硫酸制得“可燃空气”,他所说的“可燃空气”成分是 (填化学式)。“可燃空气”在纯氧中燃烧生成水,可得出“水是一个结合物而不是简单元素”。
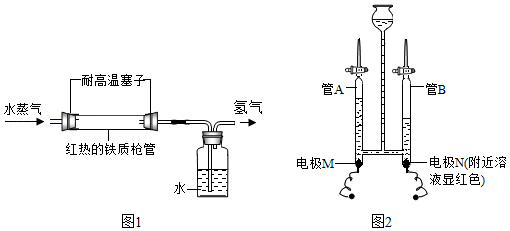
(2)1785年,拉瓦锡将水蒸气通过红热的铁制枪管将水转化为氢气,同时生成四氧化三铁,实验示意图如图1所示。上述反应的化学方程式为 。该反应若生成1g氢气,则理论上铁制枪管应增重 g。
实验发现枪管实际增重比理论数值大,其可能的原因是 。
(3)1800年,英国化学家尼科尔森通过电解水得到氢气和氧气,后人不断研究和改进该实验。现有某同学在水电解器中加入含酚酞的稀Na2SO4溶液,至充满管A和管B(Na2SO4溶液呈中性且不参与反应)。通直流电一段时间后现象如图2所示。电解结束后将容器内所有液体倒入烧杯中,溶液呈无色。
①下列说法正确的是 (填字母)。
a.硫酸钠在水中形成自由移动的Na+和SO42﹣,可增强水的导电性
b.电解过程中化学能转化为电能
c.电极N与电源负极相连
②电解后,管A中生成的微粒有 (填微粒符号)。
(4)当温度、压强分别超过临界温度(374.2℃)和临界压强(22.1MPa)时的水称为超临界水。现代研究表明:超临界水能够与氧气以任意比例互溶,由此发展了超临界水氧化技术。550℃时,测得乙醇(C2H6O)的超临界水氧化结果如图3所示。

注:δ(分布分数)表示某物质分子数占所有含碳物质分子总数的比例。
如δ(CO)
图中CO的分布分数先增后降的原因是 、 。
二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加SO2可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量≤259mg/L。
(1)SO2作为食品添加剂须严格控制用量的原因是 。
(2)为检测某国产葡萄酒SO2中的含量是否符合国家标准,进行如下实验:
步骤1 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(该指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈 色。
②向10g 30%的H2O2溶液中加入 g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。
我国海水晒盐的历史悠久。学习小组对粗盐进行提纯,并利用氯化钠进行实验探究。
Ⅰ.粗盐的提纯
粗盐中含有不溶性泥沙、可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐: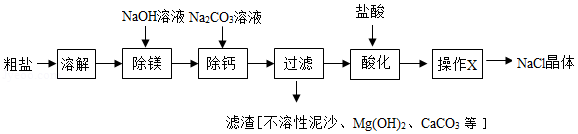
(1)用化学方程式表示Na2CO3溶液的作用: 。
(2)“过滤”中玻璃棒的作用为 ;“操作X”的名称为 。
Ⅱ.探究氨盐水与二氧化碳的反应
步骤1 取50mL浓氨水于锥形瓶中,加入NaCl晶体至不再溶解,制得氨盐水。
步骤2 向烧瓶中加入20mL氨盐水和约16g干冰,塞紧瓶盖,振荡、静置。一段时间后溶液中析出细小晶体,过滤、用冷水洗涤晶体并低温干燥。
【提出问题】晶体的成分是什么?
【实验探究1】①经甲同学检验,晶体中不含铵盐。甲同学的实验操作及现象是 。
②乙同学取晶体少许,加入稀硝酸,晶体溶解并产生无色气体,再滴加几滴AgNO3溶液,未见明显现象,说明晶体中不含有 离子。
【提出猜想】晶体的成分为Na2CO3或NaHCO3或两者的混合物。
【查阅资料】Na2CO3受热不分解;
NaHCO3受热易分解:2NaHCO3 Na2CO3+H2O+CO2↑。
【实验探究2】称取m1 g晶体,利用如图装置(夹持仪器略)探究晶体的成分。
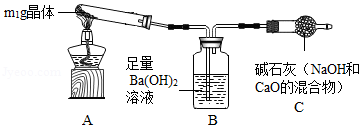
【实验现象】反应一段时间后,试管口凝结了少量小液滴,Ba(OH)2溶液变浑浊。
【实验分析】①晶体中一定含有 (填化学式)。
②将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2 g.若m1:m2= ,说明晶体为NaHCO3。
【拓展延伸】①氨盐水与二氧化碳反应所得铵盐的用途为 。
②丙同学认为通过测定装置B中沉淀的质量,经计算分析也可确定晶体的组成。请对丙同学的观点进行评价: 。