某实验小组同学用氢氧化钡溶液与稀盐酸进行酸碱中和反应实验。如图,反应一段时间发现未滴加酸碱指示剂,此时停止加入稀盐酸,立即向烧杯内滴加酚酞试液,振荡后溶液呈无色。实验结束后,他们对烧杯内的溶液的成分进行探究。(提示:BaCl2溶液呈中性)
【提出问题】该溶液中溶质是什么?
【猜想与假设】猜想一:BaCl2猜想二:BaCl2:Ba(OH)2
猜想三:
【分析讨论】该溶液中滴加酚酞试液不变色,说明溶液不显碱性,猜想二不成立。
【进行试验】
实验步骤 |
实验现象 |
实验结论 |
取该溶液少量于试管中,加入Na2SO4溶液 |
产生白色沉淀 |
猜想三成立 |
另取该溶液少量于试管中, |
|
【反思评价】分析反应后溶液中溶质的成分时,需要考虑的因素有 。

农场需用熟石灰改良酸性土壤,为了确保改良效果,需要对库存的熟石灰是否变质进行检测。农场实验室取了一定量的熟石灰样品,对其成分进行如下探究。
【提出问题】熟石灰样品的成分是什么?
【作出猜想】猜想一:
猜想二: 和
猜想三:
【资料查阅】氢氧化钙微溶于水
【实验步骤与现象】
|
步骤 |
操作 |
现象 |
|
1 |
取1g样品于试管中,加入10mL蒸馏水充分振荡 |
得到上层清液和下层固体 |
|
2 |
向步骤1后的试管中滴加几滴酚酞 |
溶液变红 |
|
3 |
向步骤2后的试管中逐滴滴加稀盐酸 |
溶液由红色变为无色,固体物质消失并产生气泡 |
【实验分析】
(1)实验人员根据步骤1认为猜想三正确。其实该结论并不严密,请说明理由 。
(2)解释步骤3有气泡产生的原因(用化学方程式表示) 。
【实验结论】通过以上实验可以知道猜想 正确。
【评价与反思】熟石灰存放时应密封保存。农业上使用库存较久的熟石灰时要检测其成分。
化学兴趣班的同学准备分组进行气体的制取与性质的探究实验,实验员准备了如图仪器,同学们根据所学知识完成下列题目。
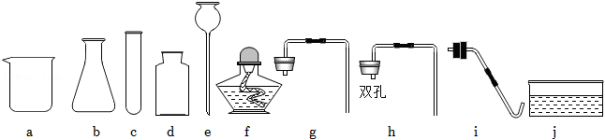
(1)请写出如图中对应字母编号为“e”的仪器名称 。
(2)甲小组的同学准备利用过氧化氢溶液制得较多量的氧气,同时便于添加液体试剂,应选择如图中的 (选填字母编号)来组成发生装置,生成氧气的化学方程式为 。
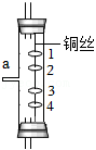
(3)乙小组的同学利用甲小组组装的发生装置制得了二氧化碳气体,并将气体从如图a端通入以探究二氧化碳的性质,其中1、4为湿润的石蕊棉球,2、3为干燥的石蕊棉球。同学们观察到2、3棉球不变色,1、4棉球变红且4棉球先变红,根据实验现象可得出二氧化碳的物理性质是 ,二氧化碳的化学性质是(用化学方程式表示) 。
某课外化学兴趣小组到华蓥山石林研学旅行,震惊于溶洞内千姿百态的石笋、钟乳石。回校后查阅教材,知道溶洞都分布在石灰岩组成的山洞中。石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙,其反应方程式为: 。当溶有碳酸氢钙的水遇热或压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来。
【提出问题】兴趣小组在研究溶洞成因后提出:
在碳酸钠溶液中通入二氧化碳气体也会发生类似的反应吗?
推测反应方程式为:
【猜想与假设】同学们做出了如下猜想:
猜想一:碳酸钠、二氧化碳和水会发生反应。
猜想二: 。
【查阅资料】①碳酸氢钠受热会分解产生碳酸钠、水和二氧化碳;
②碳酸钠与碳酸氢钠相互不反应。
【实验方案设计】
第一步:制备检测样品。向盛有 溶液的烧杯中通入一定量的二氧化碳后,通过系列的操作制得了固体,并干燥固体待用。
第二步:将第一步制得的固体加热,以检验固体中是否有碳酸氢钠。

实验装置如图一所示,在加药品前应先检查装置 。
完成上述操作后,将固体样品放入试管并加热。
【证据和推理】一段时间后,观察到烧杯内澄清石灰水变浑浊,这说明猜想 成立。请写出澄清石灰水变浑浊的化学方程式 。
【实验反思】同学们实验后讨论认为此实验设计不严密,使澄清石灰水变浑浊的二氧化碳或许来自碳酸钠分解。于是补充设计了图二的实验装置进行探究。
同学们在大试管里放碳酸钠(直接受热),小试管里放碳酸氢钠(间接受热)。一段时间后,出现 (选填下列选项中编号)的现象,则证明碳酸氢钠受热分解,碳酸钠受热不分解。由此推出图一装置产生的二氧化碳来自于碳酸氢钠的分解。
| A. |
烧杯A中澄清石灰水变浑浊,烧杯B中澄清石灰水不变浑浊 |
| B. |
烧杯A中澄清石灰水不变浑浊,烧杯B中澄清石灰水变浑浊 |
| C. |
烧杯A和烧杯B中澄清石灰水均变浑浊 |
| D. |
烧杯A和烧杯B中澄清石灰水均不变浑浊 |
【探究结论】碳酸钠、二氧化碳和水会发生反应。
二氧化碳是温室气体之一,“节能减排”“碳达峰”“碳中和”等关键词成为热搜。
(1)某化学兴趣小组设计实验验证二氧化碳温室效应。如图一所示,他们选用体积大小相等的两个塑料瓶,分别盛满同条件下的空气、二氧化碳与空气的混合物(体积比 ),并用一个小塑料管连接(在塑料管中间有一滴红墨水),置于阳光下。一段时间后红墨水滴会 移动。(选填“向右”“向左”或“不”)

(2)实验室用大理石与稀盐酸反应制备二氧化碳气体,其气体发生装置应选用图二中的 (填序号),收集二氧化碳气体时,验满的方法是 。
(3)若实验室选用A装置制备氧气,其反应的化学方程式为 。
(4)氨气通常情况下是无色、有刺激性气味、极易溶于水、密度比空气小的气体。若用如图二中D装置收集氨气,进气口应是 。(选填“a”或“b”)
化学是以实验为基础的学科。回答下列问题。
Ⅰ、如图是实验室制取气体可能用到的仪器。

(1)图中仪器D的名称是 。
(2)实验室制取氧气的化学反应方程式为 ,根据此反应选择图中仪器 (填仪器下对应字母)与H组合制取并收集氧气。
(3)用H装置收集(2)中制得的 ,则 应从 (填“a”或“b”)端通入。
Ⅱ、探究一瓶失去标签的白色固体的组成。
有一瓶失去标签的白色固体可能为 、 和 中的一种或多种,小明同学设计以下实验探究其组成。
取少量白色固体于两支试管A、B中,加蒸馏水使其溶解,向A试管中加入足量 溶液,溶液中有白色沉淀生成,再加入足量稀盐酸,沉淀全部消失,同时有气体生成;向B试管中加入足量 溶液,有白色沉淀生成,再加入足量稀 溶液,沉淀部分溶解,并有气体生成。
(4)由此证明这瓶白色固体的成分是 (填化学式),向A试管加入足量 溶液发生反应的化学方程式为 。