某课外化学兴趣小组到华蓥山石林研学旅行,震惊于溶洞内千姿百态的石笋、钟乳石。回校后查阅教材,知道溶洞都分布在石灰岩组成的山洞中。石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙,其反应方程式为: 。当溶有碳酸氢钙的水遇热或压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来。
【提出问题】兴趣小组在研究溶洞成因后提出:
在碳酸钠溶液中通入二氧化碳气体也会发生类似的反应吗?
推测反应方程式为:
【猜想与假设】同学们做出了如下猜想:
猜想一:碳酸钠、二氧化碳和水会发生反应。
猜想二: 。
【查阅资料】①碳酸氢钠受热会分解产生碳酸钠、水和二氧化碳;
②碳酸钠与碳酸氢钠相互不反应。
【实验方案设计】
第一步:制备检测样品。向盛有 溶液的烧杯中通入一定量的二氧化碳后,通过系列的操作制得了固体,并干燥固体待用。
第二步:将第一步制得的固体加热,以检验固体中是否有碳酸氢钠。

实验装置如图一所示,在加药品前应先检查装置 。
完成上述操作后,将固体样品放入试管并加热。
【证据和推理】一段时间后,观察到烧杯内澄清石灰水变浑浊,这说明猜想 成立。请写出澄清石灰水变浑浊的化学方程式 。
【实验反思】同学们实验后讨论认为此实验设计不严密,使澄清石灰水变浑浊的二氧化碳或许来自碳酸钠分解。于是补充设计了图二的实验装置进行探究。
同学们在大试管里放碳酸钠(直接受热),小试管里放碳酸氢钠(间接受热)。一段时间后,出现 (选填下列选项中编号)的现象,则证明碳酸氢钠受热分解,碳酸钠受热不分解。由此推出图一装置产生的二氧化碳来自于碳酸氢钠的分解。
| A. |
烧杯A中澄清石灰水变浑浊,烧杯B中澄清石灰水不变浑浊 |
| B. |
烧杯A中澄清石灰水不变浑浊,烧杯B中澄清石灰水变浑浊 |
| C. |
烧杯A和烧杯B中澄清石灰水均变浑浊 |
| D. |
烧杯A和烧杯B中澄清石灰水均不变浑浊 |
【探究结论】碳酸钠、二氧化碳和水会发生反应。
化学是一门以实验为基础的科学。回答下列问题:
(1)实验室中常见的气体发生装置及收集装置如图。

①选用装置 制取气体时,对药品和反应条件的要求是_______________。
②仪器 的名称是_____,实验时为防止气体从该仪器的上口逸出,应采取的措施是__________。
③铁和稀盐酸反应制取氢气的化学方程式是__________,若用排空气法收集氢气,气体应从装置 的_____(填“b”或“c”)端进入。
(2)向试管中加入 蒸馏水,滴入 滴石蕊溶液(图Ⅰ),按图Ⅱ、Ⅲ依次进行实验。

①Ⅲ中观察到的实验现象是_____。
②由于 的干扰,该实验不能直接证明使石蕊溶液变色的物质一定是 。设计实验方案排除 的干扰 _________________________。
某化学兴趣小组研究影响化学反应快慢的因素。
(1)下图是实验室中常用的仪器

①仪器A的名称是_______。
②从上图中选择合适的仪器组装一套 发生装置,要求添加盐酸无需拆开装置,需要用到的仪器有哪些?_______(填标号)
(2)该小组的实验设计和数据记录如下表。每个实验均在反应开始后,就立即用排水法连续收集多瓶 ,表中“—”表示气泡太少,不再收集。
|
序号 |
反应物 |
收集每瓶气体所用时间(单位:秒) |
|||||||
|
盐酸 浓度 |
盐酸 体积 |
大理石 形状 |
第1瓶 |
第2瓶 |
第3瓶 |
第4瓶 |
第5瓶 |
第6瓶 |
|
|
实验1 |
|
|
小颗粒 |
|
|
|
|
|
|
|
实验2 |
块状 |
|
|
|
|
|
|
||
|
实验3 |
|
|
小颗粒 |
|
|
|
|
|
|
|
实验4 |
块状 |
|
|
|
|
|
|
||
|
实验5 |
|
|
小颗粒 |
|
|
|
|
|
— |
|
实验6 |
块状 |
|
|
|
— |
— |
— |
||
①该小组研究了哪些因素对反应快慢的影响?_______
②为了分析浓度对反应快慢的影响,可对比表中实验_______(填标号)。
| A. |
|
B. |
|
C. |
|
D. |
|
③根据实验数据反映出的规律,表中数值 的合理范围是:_______< <_______。
(3)该小组在反应开始后立即收集第1瓶气体,你认为该做法合理吗?说出你的观点并阐述理由。__。
镓( )及其化合物应用广泛,常用于半导体、合金、磁性材料等领域。已知镓在化合物中常为 价,金属活动性顺序: 。
(1)镓的氧化物的化学式为_______。
(2)氢氧化镓是难溶于水的白色固体。
①上述信息中能用于推测氢氧化镓化学性质的是_______(填标号)。
| A. |
“氢氧化镓” |
B. |
“难溶于水” |
C. |
“白色固体” |
②取少量氢氧化镓固体于试管中,加入无色溶液X,充分振荡后固体完全溶解。溶液 可能是____或______。(填化学式)
(3)设计金属镓转化为氢氧化镓的一种方案:_______(依次写出化学方程式)。
某兴趣小组用氯酸钾和二氧化锰制取氧气。可能用到实验装置如图所示:

请回答下列问题:
(1) 仪器的名称_____。
(2)写出用该方法制取氧气的化学方程式_______________,其中二氧化锰的作用是_____,制取并收集干燥的氧气应选用_____(填实验装置图字母序号)。
(3)氯酸钾完全分解后,为了回收二氧化锰和氯化钾,又进行了如下实验操作:

实验操作中,操作①的名称是_____;实验操作②应选择上述图中的_____(填实验装置图字母序号)。
(4)实验结束后,同学们在拆卸装置时闻到刺激性气味。他们将回收得到的 称量,发现其质量小于加热前 的质量。查阅资料后发现,加热 和 混合物的反应过程如下:
第一步:

第二步:

第三步:

拆卸装置时闻到刺激性气味的气体是_____,根据以上信息写出加热后剩余固体中 质量小于加热前 质量的原因_______________。
某同学欲用 固体配制溶质质量分数为 的 溶液 ,用于制作“叶脉书签”。回答下列问题:
(1)为完成实验,除下列仪器外,还须用到的仪器(如图1)名称是_____。

(2)该同学称量 固体质量之前,先用托盘天平称量烧杯的质量。称量时,他把烧杯和砝码的位置放反了,天平平衡后,砝码的总和是 ,游码的位置如图2所示,则烧杯的实际质量为_____ 。
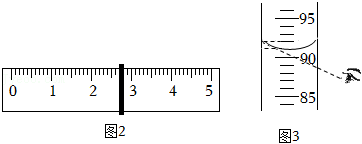
(3)该同学用 量筒量取实验所用的蒸馏水,读数视线如图3所示,量筒中水的实际体积为_____ ;若其他操作均正确,该同学所配 溶液中溶质的质量分数 _____(填“>”“<”或“=”) 。(水的密度为 )
(4) 溶液长时间露置于空气中会变质生成 ,发生反应的化学方程式为 _______________;实验室里用于盛装 溶液的试剂瓶是____________________(填“带磨口玻璃塞的广口瓶”或“带橡胶塞的细口瓶”)。
(5)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要先用大量的水冲洗,再涂上_____溶液。