小忻同学设计如下实验装置(铁架台等仪器省略)制备CO2和验证CO2能与NaOH反应。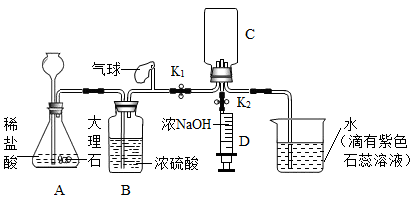
(1)装置B的作用是______。
(2)请补充画出装置C中a、b导气管
(3)小意分析实验后,发现此装置有明显不足,至少应添加一后冼气瓶F,你认为应该在_____(填装置编号)之间加入装有______(填试剂编号)洗气瓶F。
| A.浓NaOH溶液 | B.澄清石灰水 |
| C.饱和NaHCO3溶液 | D.饱和Na2CO3溶液 |
(4)打开止水夹K1,检查气密性,加入药品开始实验,当观察至装置E的现象是___________,可确定装置C收集满CO2
(5)当装置C中收集满CO2,关闭止水夹K2,把注射器D中的5mL浓的氢氧化钠压入到装置C中,化学方程式为__________________________________,观察到的现象是____________________。
(6)小平同学认为证明CO2与 NaOH反应,还应把注射器内D中浓NaOH溶液换成________,再做一次实验,其目的是__________________________。
回答下列问题。
(1)某兴趣小组参观火力发电厂,了解到废气中的SO2、NO2、CO、CO2会影响环境,设计如图流程处理废气。

①用生锈铁屑处理废气中的CO,体现CO 性。
②用石灰浆不用石灰水的原因是 。
③固体2中有 (写两种物质)。
(2)A~D为初中化学常见物质,转化关系如图。A是由两种元素组成的钙盐,C是火力发电厂排放的温室气体。

①B转化为A的化学方程式为 。
②若D广泛用于玻璃、洗涤剂的生产,则D转化为B的基本反应类型是 ;检验D中阴离子的方法是 。
③将足量C通入石蕊溶液中,现象是 ;测得该溶液pH=4,加热至90s时C完全排出,画出加热过程pH变化图像。

实验室用氯酸钾和二氧化锰制氧气,并回收产物。

(1)氯酸钾制氧气的化学方程式为 ,制取装置需铁架台、水槽和
(填序号)。
(2)收集气体时,待集气瓶里的水排完后, (填操作),把集气瓶移出水槽,正放在桌上。
(3)将完全反应后的固体溶解、过滤、洗涤、蒸发,以上操作都用到的仪器名称是 。蒸发时需铁架台和 (填序号),当 时停止加热。
(4)产物KCl可作化肥,对植物的主要作用是 (填序号)。
a.促进叶色浓绿
b.增强抗寒抗旱能力
c.增强抗倒伏能力
早在春秋战国时期,我国就开始生产和使用铁器。某实验小组利用焦炭和Fe 2O 3模拟早期炼铁并检验可能的产物,实验装置如图:

【查阅资料】①铁粉为黑色;常温下,Fe、Fe 3O 4可被磁铁吸引;
②PbCl 2溶液可用于检验CO,原理是:PdCl 2+CO+H 2O═Pd↓+CO 2+2HCl;
③Fe 3O 4与硫酸反应:Fe 3O 4+4H 2SO 4═FeSO 4+Fe 2(SO 4) 3+4H 2O。
【实验现象】澄清石灰水变浑浊,PdCl 2溶液中产生黑色沉淀,玻璃管内粉末全部变成黑色。冷却后,用磁铁靠近黑色固体,黑色固体被部分吸引。
(1)仪器A的名称是 。
(2)为了检验气体产物,装置从左到右的接口连接顺序为a→ → →
→ 。
(3)澄清石灰水变浑浊的化学方程式为 。
【实验结论】反应生成CO和CO 2,磁铁上的黑色固体可能是Fe、Fe 3O 4。
【提出猜想】磁铁上的黑色固体是什么?
猜想一:Fe
猜想二:Fe 3O 4
猜想三:Fe和Fe 3O 4
【设计实验】
|
设计思路 |
操作 |
现象 |
结论 |
|
定性实验 |
取少量黑色固体于试管中,加入足量稀硫酸,充分反应 |
固体完全溶解,产生气泡 |
猜想 成立 |
|
定量实验 |
取一定质量的稀硫酸(足量)放入烧杯中,加入5.6g黑色固体,充分反应后称量溶液的质量 |
固体完全溶解,产生气泡,溶液增加的质量为 g。 |
猜想一成立 |
【归纳总结】根据实验结论和探究结果C与Fe 2O 3反应的化学方程式为 。
化学是一门以实验为基础的科学。以下为初中化学常见实验,按要求回答问题。

(1)图A木条放在蜡烛火焰上片刻后 (填序号)处炭化程度最大。
(2)图B发现酚酞溶液变红,说明分子的性质是 。
A.分子很小
B.分子在不断运动
C.分子之间有间隙
(3)图C红磷燃烧的化学方程式为 ,实验结束后,吸入左瓶的水量明显小于左瓶空气体积的 ,可能原因是 (填序号)。
A.红磷过量
B.气密性不好
C.燃烧完成后未冷却到室温打开止水夹
(4)图D气体是实验室制取的CO 2,发现干石蕊纸花变红,可能原因是 (写一条即可)。
某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有CaCl2、MgCl2、Na2SO4等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂。
(1)配制溶液时,加速粗盐溶解的玻璃仪器是 。
【探究过程】
(2)步骤1:向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明溶液中无
杂质;向溶液中继续滴加过量Na2CO3溶液,产生白色沉淀CaCO3固体。反应的化学方程式为 。
(3)步骤2:向步骤1的滤液中滴加过量BaCl2溶液,产生白色沉淀,过滤;向滤液中滴加稀盐酸至溶液呈中性即得NaCl溶液。加稀盐酸除去的物质是 。
【初步结论】杂质成分已确定,且已完全除去。
【反思交流】
(4)小东认为Na2SO4还不能确定是否存在,可向步骤2的沉淀中滴加过量稀盐酸,若观察到 的现象,证明粗盐中确实存在Na2SO4。
(5)小红认为杂质也未完全除去,可按照步骤1和步骤2重新实验,并对调其中两种试剂的位置就能达到除杂目的,这两种试剂为 (填序号)。
A.Na2CO3溶液、BaCl2溶液
B.稀盐酸、BaCl2溶液
C.NaOH溶液、Na2CO3溶液