某校兴趣小组的同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中有一瓶溶液的试剂瓶未盖瓶盖且标签破损(如图),于是决定对该瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠.
【做出猜想】:猜想一:这瓶溶液是氯化钠溶液;
猜想二:这瓶溶液是氢氧化钠溶液;
猜想三:这瓶溶液是碳酸钠溶液.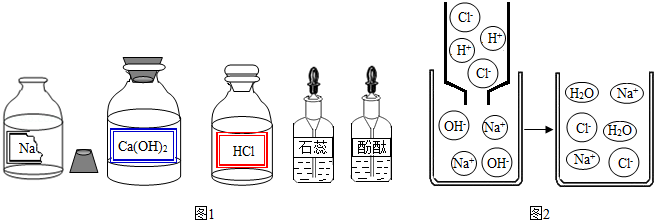
【实验推断】
(1)小明取样滴加无色酚酞溶液,溶液呈红色,得出结论:该溶液不可能是 溶液,原因是 .
(2)小李另取样滴加稀盐酸,观察到有气泡产生,由此得出结论:该溶液是碳酸钠溶液,反应的化学方程式是 .
(3)小王认为小李的结论不完全正确,理由是 .
大家讨论后一致认为还要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,设计这一步骤的目的是 ,静置后,取上层清液,滴入酚酞溶液,溶液呈红色.
【实验结论】这瓶溶液是 .
【探究启示】实验取完药品后应立即盖好瓶塞,且取用药品时标签向着手心.
【拓展迁移】若该溶液与盐酸发生中和反应,恰好完全反应的微观过程如图2所示,反应实质是 .
现有硫酸钠和氯化钠的固体混合物30g,加316.6g水使之全部溶解,将300g氯化钡溶液分三次加入该溶液中,实验数据记录如表:
|
第1次 |
第2次 |
第3次 |
|
|
加入氯化钡溶液质量/g |
100 |
100 |
100 |
|
生成沉淀的质量/g |
23.3 |
m |
46.6 |
(1)表中m的数值是 。
(2)原固体混合物中硫酸钠的质量分数是多少?(计算结 果精确到0.1%)
(3)恰好完全反应时,所得溶液中溶质的质量分数为多少?
花青素(化学式为C15H11O6)具有缓解疲劳、保护视力的作用,该物质主要来源于各种蔬菜和水果,请回答下列问题:
(1)一个花青素分子中共有 个原子;
(2)花青素分子中碳、氧元素的质量比为 ;
(3)花青素的相对分子质量为 ;
(4)花青素中氧元素的质量分数为 。(计算结果精确到0.1%)
有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成,同学们查阅资料得知NaCl、CaCl2、BaCl2等溶液呈中性,经过思考,设计并进行了以下实验:

(1)白色粉末一定不含 ,可能含有 。
(2)为了确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
[提出问题]无色滤液中呈碱性的物质是什么?
[猜想假设]猜想一:NaOH
猜想二:
猜想三:Na2CO3和NaOH
[进行实验]
|
实验步骤 |
实验现象 |
结论 |
|
1.取少量该溶液于试管中,滴入 溶液。 |
|
猜想三正确 |
|
2.静置上述溶液,取少量上层清液于另一试管中,滴入几滴 溶液。 |
|
步骤1中发生反应的化学方程式为 。
[得出结论]白色粉末的成分是 。
请根据下列装置图,回答有关问题:

(1)写出图中标号仪器的名称:① ;② 。
(2)写出用氯酸钾制取氧气的化学方程式 。
(3)做铁丝在氧气中燃烧的实验时,需要先打磨铁丝,目的是 。
(4)用向上排空气法收集氧气时,验满的方法是 。
(5)实验室要干燥二氧化碳气体,气体应从F装置的 (填“e”或“f“)管口通入。实验室制取二氧化碳的化学方程式为 。
(6)实验室用亚硫酸钠固体和浓硫酸反应制取二氧化硫,已知二氧化硫易溶于水,可在图中选用的发生装置和收集装置的组合是 (填字母)。
根据下列实验装置图填空:

(1)甲实验中,试管I中气体的名称为 ;做该实验时在水中加入少量硫酸钠的目的是 。
(2)乙实验中,烧杯c的作用是 。
(3)丙实验中,二氧化碳气体表现出来的化学性质是 。