馒头、面包等发面食品的一个特点是面团中有许多小孔,他们使发面食品松软可口。小明学习相关化学知识后,将家里制作馒头用的白色粉末带到实验室与兴趣小组的同学一起进行探究。
【初步探究】取少量白色粉末于试管中,加适量水,测得溶液的 pH>7,说明溶液呈 性。
【提出问题】白色粉末成分是什么?
【查阅资料】
(1)碳酸钠、碳酸氢钠都可用于制作发面食品。
(2)碳酸氢钠不稳定,受热易分解生成二氧化碳和水等; 碳酸钠很稳定。
【猜想与假设】
猜想Ⅰ:碳酸钠
猜想Ⅱ:碳酸氢钠
【实验探究】甲乙兴趣小组设计不同实验方案进行探究。

甲组方案:如图1,取适量白色粉末于试管中,将导管伸入澄清石灰水,加热,澄清石灰水变浑浊,猜想Ⅱ正确。写出装置B中反应的化学方程式 。
乙组方案:用如图2所示装置作为反应容器,准确测量生成气体的体积以判断白色粉末的成分。
分别向盛有碳酸钠、碳酸氢钠和白色粉末的锥形瓶中,注入等体积、等浓度的足量的稀盐酸,记录如表:
实验编号 |
锥形瓶内物质[来源 |
最终得到 CO 2体积/mL |
|
名称 |
质量/g |
||
① |
碳酸钠 |
a |
V 1 |
② |
碳酸氢钠 |
a |
V 2 |
③ |
白色粉末 |
m |
V 3 |
实验①的化学反应方程式为 ; 表中 m= g; 根据上表中数据分析,猜想Ⅱ正确,判断的依据是 。
【反思应用】
(1)甲组方案中,无法判断白色粉末是否为碳酸钠和碳酸氢钠的混合物;乙组方案可以判断,如果是两者的混合物,应该满足的条件是 。
(2)家中制作馒头、面包时,将面粉发酵(产生有机酸),再加入适量的碳酸氢钠,可以使馒头、面包松软。原因是 。
某同学阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】他以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
| 实验序号 |
KClO3质量 |
其他物质质量 |
待测数据 |
| ① |
1.2g |
/ |
|
| ② |
1.2g |
CuO 0.5g |
|
| ③ |
1.2g |
MnO2 0.5g |
(1)上述实验应测量的“待测数据”是。
(2)若实验②比实验①的“待测数据”更(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
(3)将实验②反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到0.5g黑色粉末,再将黑色粉末放入试管中,。(简述操作和现象)
【预期结论】氧化铜也能作氯酸钾的催化剂。
【评价设计】你认为小雨设计实验③和实验②对比的目的是。
气体分子之间的间距比较大,所以容易被压缩。某同学想:当气体的质量一定时,气体压缩,体积减小的时候,气体压强将会怎样变化呢?
(1)他提出了两个猜想:
猜想A:一定质量的气体,压缩体积,压强减小;
猜想B:一定质量的气体,压缩体积,压强增大。
但经仔细一想,该同学马上否定了自己的猜想A。
你认为该同学否定猜想A的理由是:。
(2)进一步思考:压强和体积的变化满足什么样的关系呢?
他找来一个注射器和一个气压计,在注射器里边封了30ml空气(不计注射器活塞重力和摩擦,注射器完全密封,大气压强P0=1.0×105Pa)。
查阅资料得知:气体被压缩的时候,内能增加,温度上升也引起压强的变化。所以在下面的实验过程中要注意控制相同。
以下是该同学实验时记录的数据:
| 实验次数 |
1 |
2 |
3 |
4 |
5 |
| 体积(ml) |
30 |
25 |
20 |
15 |
10 |
| 压强(×105pa) |
1 |
1.2 |
1.5 |
V |
3 |
(3)表格中V=;
(4)分析以上数据,写出一定质量气体的体积和压强定量关系。
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应。
(1)实验准备
①查阅资料:NaHCO3+NaOH=====Na2CO3+H2O
②用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
| NaHCO3溶液 |
NaOH溶液 |
Na2CO3溶液 |
|
| 加入稀盐酸 |
现象Ⅰ |
无明显变化 |
产生气泡 |
| 加入澄清石灰水 |
溶液变浑浊 |
无明显变化 |
现象Ⅱ |
| 加入CaCl2溶液 |
无明显变化 |
溶液变浑浊 |
溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
澄清石灰水 无明显变化 |
表中的现象Ⅱ为_________
(2)实验过程
【实验1】证明反应生成了Na2CO3
同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是__________。
有同学提出这个实验不足以证明有Na2CO3生成,其理由是_________。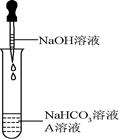
【实验2】证明反应后NaHCO3不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是________。
某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。碱溶液可以使酚酞溶液变红是因为碱在水溶液中解离出OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞溶液变红呢?为此他们设计了如下图所示的3个实验,请你和他们一起探究。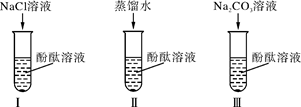
(1)实验Ⅰ可以证明____________________________________。
(2)实验Ⅱ加入蒸馏水的目的是____________________________;小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是______________________________________。
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到_____________________________________。
由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞溶液变红。
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞溶液变红也是由于溶液中存在OH-”。你认为Na2CO3溶液中存在OH-的原因是______________________________________。
化学教材 “寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】(1)氧化铁能否作过氧化氢溶液分解的催化剂?
(2)氧化铁与二氧化锰催化效果哪个好?
【实验探究】
| 实验步骤 |
实验现象 |
| ①分别量取5 mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入a g氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象。 |
A试管中产生大量气泡,带火星木条复燃,B试管中的现象 |
| ②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次实验,观察现象。 |
试管中均产生大量气泡,带火星木条均复燃 |
| ③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为a g。 |
|
| ④分别量取5 mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入a g氧化铁粉末,向D试管中加入a g二氧化锰粉末,观察现象。 |
  |
(1)A中产生的气体是 ;B试管中的现象。
(2)实验②、③证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式 。
(4)实验设计④的目的是,若实验④观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。