小明在实验室发现一瓶未密封的KOH固体,对其成分进行实验探究。
【查阅资料】:①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是 。
②K 2CO 3溶液呈碱性,CaCl 2溶液,KCl溶液呈中性。
【猜想假设】:假设I:只含KOH;假设II:含KOH和K 2CO 3;假设III:只含K 2CO 3。
【进行实验】
实验操作步骤 |
实验现象 |
实验结论 |
(1)取少量样品于试管中,加入足量的稀盐酸 |
有气泡 产生 |
假设 不正确 |
(2)另取少量样品于试管中,加水溶解,加入过量的CaCl 2溶液,振荡,静置 |
|
猜想II正确 |
(3)取②中上层清液,滴加无色的酚酞试液 |
|
【拓展应用】:完全变质的KOH也有利用价值,从K 2CO 3的组成或性质看,K 2CO 3在农业上的用途是 (填一种即可)。
某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
| 实验装置 |
实验步骤及操作 |
实验现象 |
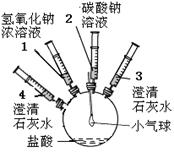 |
①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 |
气球变瘪 |
| ②将注射器3稍稍向外拉 |
澄清石灰水变浑浊 |
|
| ③将注射器1中的溶液推入瓶中 |
气球鼓起 |
|
| ④ |
无明显现象 |
|
| ⑤将注射器4中的溶液推入瓶中 |
(一)(1)步骤①中气球变瘪的原因;
(2)步骤①、②可得出碳酸钠具有的性质;
(3)步骤④的操作是,其目的是;
(4)步骤⑤中发生反应的化学方程式;
(5)步骤③④⑤可得出碳酸钠具有的性质;
(二)上述实验结束后,实验小组的同学又对瓶内溶液的成分十分好奇,进行了探究:
(1)【提出猜想】通过分析,一致认为瓶内溶液的溶质中一定含有,可能含有氢氧化钙或。
(2)【实验验证】设计实验方案确定溶液中溶质的组成.
| 实验操作 |
实验现象 |
实验结论 |
| 分别取少量溶液于A、B两支试管中,A中 加入CaCl2溶液,B中加入Na2CO3溶液 |
A中产生白色沉淀,B中没有沉淀 |
瓶内溶液中溶质的成分为 |
(3)【反思与交流】根据所学化学知识,除了以上方案外,下列哪些物质可以代替试管B中加入的Na2CO3溶液完成该实验?(填序号)
a.K2CO3 b.BaCO3 c.CO2 d.无色酚酞 e. CuSO4
四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表所示。
| Zn(OH)2 |
Fe(OH)2 |
Mg(OH)2 |
|
| 开始沉淀的pH |
5.7 |
7.6 |
10.4 |
| 沉淀完全的pH |
8.0 |
9.6 |
12.4 |
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液。
(3)制备Fe3O4的实验流程如下:
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为(写出其中一个)。
(2)操作a的名称为。该操作需要的玻璃仪器有烧杯、玻璃棒、等。玻璃棒在此操作中的主要作用是。
(3)溶液1所含溶质有(至少写两种成分的化学式);溶液3所含溶质的主要成分为(写名称)。
小军同学在学习酸碱盐有关知识时,对一些沉淀物质的颜色产生了兴趣。老师告诉他氢氧化铜是蓝色、氢氧化铁是红褐色,让他自己探究氢氧化亚铁的颜色。下面请你和他一起探究。
【查阅资料】
(1)铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
(2)氢氧化亚铁在空气中立即被氧化。
(3)硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色。
【提出猜想】
氢氧化亚铁是浅绿色。
【实验过程】
在2支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。请补充完成下表:
| FeCl3溶液 |
FeSO4溶液 |
|
| 滴入NaOH溶液的现象 |
生成红褐色沉淀 |
先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色沉淀。 |
化学方程式 |
① |
FeSO4+2NaOH = Fe(OH)2↓+Na2SO4 Fe(OH)2 + ②+ H2O = ③ (完成并配平此化学方程式) |
【学习交流】
(1)氢氧化亚铁是 ①色而不是浅绿色。
(2)小军联系到CO2与C的反应,认为FeCl3溶液可以转化为FeCl2溶液。你认为小军的理由是 ①。
为探究铁和铜的金属活动性顺序,请根据实验室现有的仪器和药品条件(如下所列),通过填写下表,完成对实验方案的构思。
【实验仪器】试管、胶头滴管、镊子
【实验药品】铁钉、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液、硫酸铜溶液
| 方案 |
所选药品 |
有关化学方程式 |
| 1 |
||
| 2 |
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应? 在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应。
(1)实验准备
①查阅资料:NaHCO3+NaOH = Na2CO3+H2O Ca(OH)2+ Na2CO3 = CaCO3↓ + 2NaOH
CaCl2+2NaOH = Ca(OH)2↓(微溶)+ 2NaCl 2NaHCO3(溶液) Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
NaHCO3+HCl =NaCl+H2O+CO2↑ Ca(OH)2+NaHCO3 = CaCO3↓+NaOH+H2O
②前期实验:
用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
| NaHCO3溶液 |
NaOH溶液 |
Na2CO3溶液 |
|
| 加入稀盐酸 |
产生气泡 |
无明显变化 |
产生气泡 |
| 加入澄清石灰水 |
溶液变浑浊 |
无明显变化 |
溶液变浑浊 |
| 加入CaCl2溶液 |
无明显变化 |
溶液变浑浊 |
溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
澄清石灰水 无明显变化 |
证明NaOH溶液与NaHCO3溶液反应生成了Na2CO3
同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是_________________。 有同学提出这个实验不足以证明有Na2CO3生成,其理由是______________________________________。为了证明有Na2CO3生成,需要继续进行的操作是:取少量反应后的滤渣加入足量的 ___________,若产生无色气体证明有Na2CO3生成,反之则没有。 