菱铁矿和赤铁矿一样,也是工业上冶炼铁的一种矿物。某种菱铁矿中铁元素的主要存在形式是碱式碳酸亚铁,为测定碱式碳酸亚铁[xFeCO3•yFe(OH)2•zH2O]的组成,华雪同学在老师的指导下设计了如图实验装置:
【查阅资料】

a.碱式碳酸亚铁受热会完全分解生成FeO、CO2和H2O。
b.FeO是一种黑色粉末,它不稳定,在空气中加热,可被氧化成四氧化三铁。
c.石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
【实验步骤】
(1)检查装置的 后,准备称取3.40g碱式碳酸亚铁粉末放在装置B中,连接仪器。
(2) ,鼓入一段时间空气,准确称量装置C、D、E的质量。
(3)关闭弹簧夹K,加热装置B至装置C中导管末端无气泡冒出,再打开弹簧夹K,缓缓通空气一段时间,这样操作的目的是 。
(4)再次准确称量装置C、D、E的质量,所得数据如下
装置C/g |
装置D/g |
装置E/g |
|
加热前 |
200.00 |
180.00 |
180.00 |
加热后 |
200.36 |
180.88 |
180.00 |
(5)图,分析表中数据可知:3.40g碱式碳酸亚铁受热分解过程中生成H2O的质量为 g,CO2的质量为 g,装置E的作用是 。
【实验结论】
在xFeCO3•yFe(OH)2•zH2O中,氢原子与氧原子的个数之比为 。
【实验反思】
(1)装置A的作用是 。
(2)实验结束后,装置B中的残留固体可能全部是FeO.也可能全部是Fe3O4.还可能是 。
(3)为了得到装置B中残留固体的组成,华雪同学称得装置B中残留固体质量为2.24g后,通过计算可知:残留固体的组成及各成分的质量为 。
以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
| 实验序号 |
过氧化氢溶液浓度/% |
过氧化氢溶液质量/g |
温度/℃ |
二氧化锰用量/g |
氧气体积/ml |
反应所需时间/s |
| ① |
5 |
12 |
20 |
0.2 |
125 |
11 |
| ② |
30 |
12 |
20 |
0.2 |
125 |
2 |
| ③ |
30 |
12 |
40 |
/ |
125 |
148 |
| ④ |
30 |
12 |
90 |
/ |
125 |
82 |
(1)通过实验①和②对比可知,化学反应快慢与有关,其关系是。
(2)通过对比实验和可知,化学反应快慢与温度的关系是。
(3)除了上述的两个因素能影响化学反应快慢,你认为另一个影响因素是什么,其关系是怎样的?。
(4)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是
。
有空气、氧气、二氧化碳三种无色气体如何一次性将它们鉴别出来,请写出操作方法、现象、结论。
用来测定空气成分的方法很多,如图所示是小明用红磷在空气中燃烧的测定方法。实验过程是: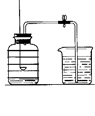
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸
入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
请回答下列问题:
(1)上面的实验同时证明了氮气有的化学性质。
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是。(至少二点)
(3)某同学选用木炭代替红磷进行实验,是否可行?为什么?
探究实验报告一:蜡烛及其燃烧的探究
探究实验的名称:蜡烛及其燃烧的探究
探究实验的目的:理解掌握蜡烛的有关性质知识
实验用品:蜡烛、火柴、等
| 步骤和方法 |
现象 |
分析 |
|
| 点燃前[ |
蜡烛是白色蜡状固体,硬度小,稍有气味 |
||
| 用小刀切下一小块蜡烛投入水中 |
石蜡浮于水面 |
||
| 点燃蜡烛 |
蜡烛先熔化后气化,再燃烧;火焰明亮且明显分成三层 |
||
| 在烛焰上方罩一干燥烧杯 |
烧杯内壁出现水雾或水珠 |
||
| 在烛焰上方罩一个内壁沾有澄清石灰水的烧杯,振荡 |
烧杯内壁出现白色斑点 |
||
| 熄灭蜡烛 |
火焰熄灭,灯芯上产生一缕轻烟 |
轻烟为蜡烛蒸气冷却所致,遇明火可以燃烧。 |
结论:在通常情况下,蜡烛是白色蜡状固体,稍有气味,熔点、熔点较低,硬度较小,密度比水小。蜡烛在点燃条件下能燃烧,燃烧产物中有水和二氧化碳等。
问题和建议:为进一步说明蜡烛是先气化,然后是石蜡蒸气燃烧,可用一根尖嘴的细玻璃管插入焰心,然后在尖嘴处点燃。根据是否能点燃,可推断上述猜测是否正确。
图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是小明对原实验装置进行了改进,装置如图Ⅱ。
【实验操作】
a.向B、C、E三支试管中分别加入5mL的蒸馏水,各滴入1 -2滴无色酚酞溶液,振荡,观察溶液颜色。
b.在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟。
【分析讨论】:
(1)E试管放有酚酞溶液的目的是。
(2)进行操作b时观察到的现象是。
(3)由此可以得到的实验结论是①,②。
(4)对比改进前的实验,改进后实验的优点是。