科学家尝试通过多种途径减少CO 2的排放,或将CO 2转化为有用的物质。其中一种途径是利用NaOH溶液来"捕捉"CO 2,并将CO 2储存或利用,反应流程如图所示。

(1)反应分离室中分离物质的操作是 。
(2)上述反应流程中,可循环利用的物质是 。
(3)若反应分离室中有溶质质量分数为10.6%的Na 2CO 3溶液100千克,求完全反应后,理论上可生成CaCO 3的质量(要求根据化学方程式计算)。
请用所学的知识回答下列问题:
(1)量取液体时,如果视线没有与量筒内无色液体凹液面的最低处保持水平,而是采用俯视的方法,将会对读数产生什么影响?
(2)为什么菜刀、镰刀、锤子等用铁制而不是铝制?
氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡。闪锌矿(主要成分为ZnS)是含锌的主要矿物质之一,高温煅烧闪锌矿生成氧化锌和SO2,以氧化锌产品为原料制备纯氧化锌的生产工艺流程如图:

(1)已知A为碳酸锌和硫酸钠的混合物,则滤渣2的化学式为 。
(2)上述步骤中,步骤⑥的操作是 (填操作名称)。
(3)在上述步骤中,步骤 发生的反应属于分解反应。
(4)步骤④中发生的反应化学方程式为 (提示:ZnO与酸反应和Fe2O3与酸反应类似)。
在探究金属活动性顺序时,华雪同学把两根绕成螺旋状的洁净铜丝分别浸入硫酸铝溶液、硝酸银溶液中,过一会儿取出:
(1)铜丝浸入硫酸铝溶液中,可观察到的现象是: 。
(2)铜丝浸入硝酸银溶液中,可观察到铜丝上有 色物质生成,溶液逐渐变成蓝色。
(3)铜丝浸入硝酸银溶液中,离子数目减少的是 ,离子数目增加的是 。
(4)根据上述实验所观察到的现象,华雪同学 (填“能”或者“不能”)证明铝、铜、银的金属活动性顺序Al>Cu>Ag
纯净的二氧化硅是现代光学及光纤制品的基本原料。请回答下列问题:
(1)二氧化硅的化学性质很不活泼,氢氟酸(HF)是唯一可以与之发生反应的酸(生成物为水和四氟化硅气体),该反应的化学方程式为 。
(2)二氧化硅与碳酸钙在高温下反应生成硅酸钙( CaSiO3)和二氧化碳:在物质的分类①单质②化合物③氧化物④酸⑤碱⑥盐中,硅酸钙属于 (填序号)。
铁是一种常见的金属,也是目前世界上年产量最高的金属。下面归纳了初中化学有关铁的知识。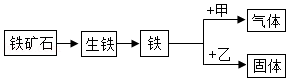
(1)比较生铁和纯铁,其中硬度较大的是 。
(2)焦炭的主要成分是碳,在生铁冶炼过程中,焦炭参与了下列反应:
①C+O2 CO2 ②C+CO2
CO2 ②C+CO2 2CO
2CO
其中为冶炼生铁提供热量的反应是 (填序号)。
(3)物质甲的阳离子符号是 。
(4)若铁与物质乙反应时,火星四射,则生成物中固体的化学式是 。
(5)若固体为红色单质,则铁与物质乙反应的化学方程式是 (任写一个)。