某工业品盐酸的溶质的质量分数为37%.请回答:
(1)将该盐酸敞口露置于空气中,一段时间后,其溶质的质量分数 37%(填“大于”“小于”或“等于”);
(2)该盐酸因含有少量Fe3+而显黄色(其他杂质忽略不计)。现取少量样品,与适量硝酸银溶液恰好完全反应。经实验测得,反应后溶液中的H+和NO3﹣的个数比为91:94,则该盐酸中Fe3+和Cl﹣的个数比为 。
有下列物质:①洁净的空气 ②水银 ③澄清石灰水 ④冰水共存物 ⑤稀盐酸 ⑥高锰酸钾
⑦高锰酸钾制氧气后的固体剩余物 ⑧液态的氧气⑨氨气。请用序号填空:
(1)属于混合物的是;(2)属于单质的是;
(3)属于化合物的是;(4)属于氧化物的是。
(5分)现有六种物质:①肥皂水、②干冰、③氧气、④酒精、⑤氮气、⑥石墨·
请选择相应物质的序号填空:
(1)空气中含量最多的气体是(2)实验室中常用的燃料是
(3)可用于人工降雨的是(4)可用于制铅笔芯的是
(5)常用于区分硬水与软水的是
请用化学用语表示:
(1)2个镁离子(2)三个铝原子_____ (3)碳酸分子_______
(4)两个氢氧根______(5)n个氧分子_____ (6)2个氨分子
(每空1分,共5分)将滴有酚酞试液的滤纸条放在试管里,如下图所示放在实验台上。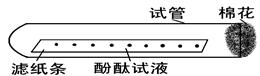
(1)用仪器A吸取浓氨水滴在试管口的脱脂棉上(10~15滴),
A的名称为,该仪器的用途为
(2)实验中须在试管下放一张白纸,白纸的作用为
(3)实验中观察到的现象为
(4)该实验可以得出的结论有许多,请你试着写两条
a,
b.
现有下列A、B、C、D、E五种实验装置,根据题意,将装置的序号填入下列空格中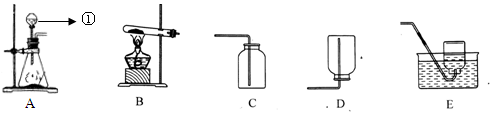
(1)写出指定仪器的名称:①;
(2)用高锰酸钾制取氧气,发生装置选用:(填序号)、写出用高锰酸钾制取氧气的文字或符号表达式;
(3)若要收集比较纯净的氧气,应选用(填序号)
(4)用过氧化氢溶液制取氧气,发生装置选用(填序号)写出用过氧化氢溶液制取氧气表达式;用此方法制氧气和用高锰酸钾制氧气相比,其优点是(写一条)。
(5)氨气无色、有刺激性气味,极易溶于水,密度比空气小;实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气。则发生装置应用(填序号);收集氨气装置最好用(填序号)
(6)下图是化学中“有名”的装置,有如下用途:医院里给病人输氧,为了给氧气加湿和观察氧气的输出速度,也可以在氧气瓶和病人之间连接该装置,在集气瓶装半瓶水,将______端接氧气钢瓶,通过观察_____________就知道氧气的输出速度。