为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图。
(1)上述反应产生二氧化碳的质量为 g;
(2)计算该赤铁矿石中氧化铁的质量分数。

某化工厂的废液中主要含有硝酸银、硝酸铜。取一定量的该废液样品,加入镁粉和铜粉,充分反应后过滤,得到滤液和滤渣。 请填写下列空格:
(1)若滤渣中有镁粉,则滤渣中除镁粉外还含有 (填写化学式,下同)。
(2)若滤渣中有铜粉,则滤液中的溶质一定含有 ,可能含有 。
(3)若滤渣中没有铜粉,则滤液中的溶质一定含有 ,可能含有 。
(4)反应后得到滤液的质量 (选填“小于”、“大于”或“等于”)反应前所取废液样品的质量。
实验室用100g 溶质质量分数为 6.8%的过氧化氢溶液与少量二氧化锰混合制取氧气,计算完全反应后生成氧气的质量是多少?(写出计算步骤,计算结果保留一位小数)
化学实验是进行科学探究的重要手段。请填写下列空格:
(1)黄铜是铜锌合金,将外形完全相同的纯铜片和黄铜片相互刻划,该实验的目的是比较它们的 大小。
(2)用坩埚钳夹取一小块木炭,在酒精灯上加热至燃烧,然后将木炭插入盛有氧气的集气瓶内,观察现象。 据此可知,可燃物燃烧的剧烈程度与 有关。
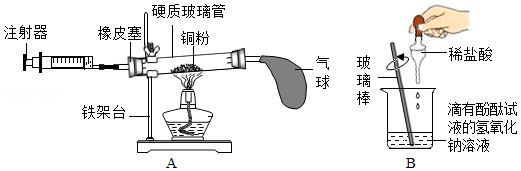
(3)用图 A 所示的装置可测定空气中氧气的含量。 该实验的原理是通过 (选填“化学”或“物理”)方法分离或除去混合物中的一种成分,从而测定混合物中某成分的含量。
(4)用图B 所示的装置探究酸碱中和反应。将稀盐酸滴入氢氧化钠溶液(滴有酚酞试液)中至过量,观察到的现象是 。从微观角度分析,中和反应的实质是 。 请另外写出一个符合上述反应实质的化学方程式 。
能源、材料、环保、食品等问题越来越引起人们的重视.请从化学的视角分析下列有关问题并填写空格:
(1)化石燃料包括煤、石油和 .
(2)铝合金可用于制造飞机的外壳,铝合金属于 (选填“合成材料”、“金属材料”或“复合材料”).
(3)塑料在为我们的生活创造便利的同时,也对环境造成不利影响. 人们把塑料给环境带来的危害称为“ ”.
(4)为了合理膳食,营养均衡,生活中把榨好的蔬菜汁放到面粉中,做成口味独特、营养丰富的蔬菜馒头,这种馒头提供的主要营养物质是 和 .
22]属于 (选填“氮肥”、“钾肥”或“磷肥”).
为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实验,请根据图示回答问题:

(1)甲同学设计的实验如图 A 所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应后,托盘天平的指针 (选填“向左”、“向右”或“不”)偏转,原因是 。
33),通过实验得出结论:化学反应前后物质的总质量 。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在 装置中进行。
(4)从微观角度分析,在化学反应前后一定不变的是 (选填序号)。
①原子种类 ②分子种类 ③原子数目 ④分子质量 ⑤分子数目 ⑥原子质量。