化学实验是进行科学探究的重要手段。请填写下列空格:
(1)黄铜是铜锌合金,将外形完全相同的纯铜片和黄铜片相互刻划,该实验的目的是比较它们的 大小。
(2)用坩埚钳夹取一小块木炭,在酒精灯上加热至燃烧,然后将木炭插入盛有氧气的集气瓶内,观察现象。 据此可知,可燃物燃烧的剧烈程度与 有关。
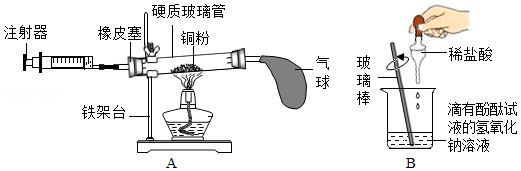
(3)用图 A 所示的装置可测定空气中氧气的含量。 该实验的原理是通过 (选填“化学”或“物理”)方法分离或除去混合物中的一种成分,从而测定混合物中某成分的含量。
(4)用图B 所示的装置探究酸碱中和反应。将稀盐酸滴入氢氧化钠溶液(滴有酚酞试液)中至过量,观察到的现象是 。从微观角度分析,中和反应的实质是 。 请另外写出一个符合上述反应实质的化学方程式 。
工业上从海水中提取出MgCl2、KCl两种物质的混合物,为了测定其中KCl的质量分数,现进行如下测定:取混合物样品19g,向其中加入100g水,完全溶解后,滴加KOH溶液,生成沉淀的质量与加入KOH溶液的质量关系如图所示。
请计算:
(1)混合物样品中KCl的质量分数。
(2)当恰好完全反应时,所得溶液中溶质的质量分数。

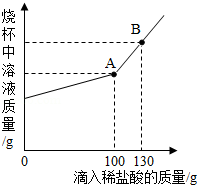
侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。现有碳酸钠和氯化钠的混合物样品12.5g,将其放入干净的烧杯中,加入100g水,使其完全溶解。向所得溶液中加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。
(1)B点时,烧杯中溶液里存在的阳离子为 (填写离子符号)。
(2)在碳酸钠和氯化钠的混合物样品中,含碳酸钠的质量为 (结果精确至0.1g)。
(3)A点时,求此温度下所得不饱和溶液中溶质质量分数(写出具体计算过程,计算结果精确至0.1%)。
同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有 (填写化学式,下同),可能含有 ;
②滤渣中一定含有 ,可能含有 。
(2)若反应后所得滤液呈无色,则滤渣中一定含有 (填写化学式)。
(3)反应后所得滤液的溶质质量分数 (选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
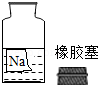
某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。
【提出问题】这瓶溶液的溶质是什么?
【获得信息】
(1)酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
(2)实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
(3)碳酸氢钠溶液与氯化钡溶液不反应;氯化钡溶液呈中性。
【提出猜想】猜想一:氢氧化钠; 猜想二:碳酸钠; 猜想三:碳酸氢钠。
【实验探究】
(1)小军取样滴加稀盐酸有 产生,得出结论:该溶液的溶质是碳酸钠或者是 。
(2)小军另取样加入过量的氯化钡溶液,观察到有 产生,进而得出结论:该溶液的溶质是碳酸钠。
(3)小华认为小军的结论不完全正确,理由是 。
小组同学讨论后一致认为还需要进行如下实验:
(4)取小军第二次实验后的上层清液,滴入无色酚酞试液,溶液呈红色。
【实验结论】这瓶溶液的原溶质是 。
【探究启示】实验中取用液体药品时,应注意 。
某气体可能含有氢气、一氧化碳、二氧化碳、水蒸气中的一种或几种。某兴趣小组利用图中的实验装置设计实验,探究气体的成分。请用符合题目要求的装置序号填空(装置可以重复使用,除杂试剂均足量)。
提示:CO+CuO  Cu+CO 2,H 2+CuO
Cu+CO 2,H 2+CuO  Cu+H 2O;无水硫酸铜粉末遇水变蓝色。
Cu+H 2O;无水硫酸铜粉末遇水变蓝色。

(1)若检验气体中是否存在水蒸气,可将该气体通入装置 。
(2)将气体依次通过装置 ,可检验并除去该气体中的二氧化碳。
(3)若检验气体中是否存在一氧化碳,可将该气体依次通过装置 。
(4)将气体依次通过装置 ,可一次性确定该气体的成分。