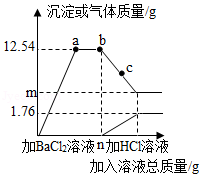
某环保小组监测到一造纸厂排放的废水中含有碳酸钠和硫酸钠两种物质,为测定废水中这两种物质的含量,环保小组的同学进行了以下实验:取该造纸厂排放的废水200g,先向其中加BaCl2溶液至ng后停止,然后再滴加稀盐酸,反应过程中加入溶液的质量与产生沉淀和气体的质量关系如图所示.
(假设废水中其它成分不参与反应;钡的相对原子质量为137)
请根据图象与数据分析计算:
(1)a、b、c三点对应的溶液中所含BaCl2的质量关系是 (用“>”、“<”或“=”表示).
(2)m值等于 .
(3)该废水中硫酸钠的溶质质量分数(写出计算过程).
早在春秋战国时期,我国就开始生成和使用铁器了。工业上炼铁的原理利用一氧化碳和氧化铁的反应。某校化学兴趣小组利用如图装置进行炼铁原理的实验探究(夹持装置省略)。请按要求填空:
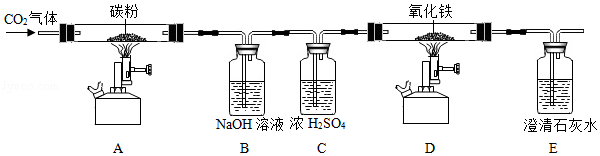
(1)写出装置A中反应的化学方程式: 。
(2)装置B的作用为 ,写出其中反应的化学方程式: ;
(3)当装置D硬质玻璃管中看到的现象为 、装置E中看到的现象为 时,说明装置D中反应发生了。
(4)同学们在讨论实验时,发现该装置存在一个不环保的缺陷,请你指出来: 。
实验室利用如图所示装置进行实验,请回答下列问题。

(1)写出图中标有字母的仪器名称:a: ;b: 。
(2)王鸿同学欲用高锰酸钾制取氧气,他选用的发生装置是 (填序号),实验时在该装置试管内靠近管口位置放一团棉花,其目的是 ;请你帮他写出反应的化学方程式: 。
(3)同学们欲用大理石和稀盐酸制取并获得干燥纯净的二氧化碳,选用装置②、④外,还选用了装置⑥两次,装置⑥中的液体依次是饱和碳酸氢钠溶液和浓硫酸,其作用分别是 、 ,气体应从装置⑥的(填"E"或"F") 端进入。
日常生活中使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所填充,其结构如图1所示。某学校化学兴趣小组的同学准备从废旧的干电池中分离出二氧化锰,并制备硫酸锌固体。

Ⅰ:设计回收二氧化锰的流程如图2所示:
(1)操作①和操作②的名称都是 ,该操作中玻璃棒的作用是 。
(2)上述操作中灼烧滤渣的目的是 。
(3)为了有效回收、利用二氧化锰,小茗同学用回收的二氧化锰与双氧水来制取氧气,请你写出该反应的化学方程式 。
Ⅱ:制备硫酸锌固体的实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应
②将滤液加热浓缩,得到热的饱和溶液
③将上述反应后的混合物过滤
④降温结晶
⑤过滤,得到ZnSO 4•7H 2O晶体
(1)正确的实验操作顺序为(填序号) 。
(2)步骤①中反应的化学方程式 。
Ⅲ:废旧干电池随意丢弃会造成环境污染。请你指出对废旧干电池的处理意见(只填一条): 。
如图框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B、D属于金属氧化物,M是一种常见的酸,N是一种黑色固体,G是金属单质,它们之间的相互转化关系如图所示(部分生成物已略去)。请回答:

(1)写出下列物质的化学式:C ,M 。
(2)写出②的反应类型: 。
(3)写出③的化学方程式: 。
(4)写出一条生活中G的常见用途 。
盐酸可以除铁锈。
(1)将一根生锈的铁钉放入足量的稀盐酸中,观察到铁锈逐渐消失,溶液由无色变成 ,该反应的化学方程式为 ,其基本反应类型为 。一段时间后,又观察到铁钉表面有气泡产生,该反应的化学方程式为 。
(2)写出一种防止铁制品锈蚀的方法 。