医疗上常用硫酸钡作透视肠胃的内服剂,俗称“钡餐”。若误将碳酸钡代替硫酸钡作“钡餐”,就会致人中毒。为除去某硫酸钡中混有的碳酸钡,并得到硝酸钡溶液。现取25g该硫酸钡和碳酸钡的混合物于烧杯中,逐滴加入稀硝酸至恰好完全反应,共用去稀硝酸245.7 g,反应后称得烧杯中物质总质量为266.3 g。
(温馨提示:化学反应方程式为BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑) 请计算:
(1)生成二氧化碳 g;
(2)所得硝酸钡溶液中溶质的质量分数。
铜是一种常见的金属,在生活、生产中有广泛的应用.
(1)电气工业上常用铜作电缆的内芯,是利用铜具有良好的 性;
(2)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了"铜绿"[化学式:Cu x(OH) yCO 3].
小明和小丽为了探究"铜绿"的组成,查阅资料:"铜绿"受热易分解生成CuO、CO 2和H 2O.他们进行如下实验:称取22.2克"铜绿",充分加热至固体质量不再改变,把产生的气体全部依次通过足量浓硫酸和足量氢氧化钠的溶液,发现浓硫酸增重1.8克,氢氧化钠溶液增重4.4克.
根据以上实验.他们推断出:x= ,y= ;铜与潮湿空气中变成"铜绿"的化学方程式是 ;
(3)小明和小丽分别取24.0克氧化铜,用CO还原制铜,小明得到19.2克红色固体,小丽得到20.8克红色固体.他们质疑:为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu 2O)
Ⅱ.Cu 2O+H 2SO 4(稀)═Cu+CuSO 4+H 2O
他们分析推断:
①一致认为 (填"小明"或"小丽")的产物中没有Cu 2O;
②用CO还原a克Cuo得到红色固体b克,若红色固体为Cu和Cu 2O的混合物,则a与b的数量关系是 ;
③还可以简单的实验验证红色固体是否有Cu 2O,请简述操作、现象及结论: .
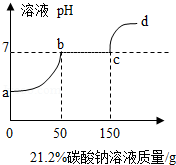
往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
(1)a→b段表示碳酸钠与混合溶液中的 反应;
(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)
焦亚硫酸钠有毒,不能直接用于食品加工,市场上有不法商贩将其溶液浸泡生姜,使生姜发黄发亮,食用此种生姜可能使人中毒,已知焦亚硫酸钠的化学式为Na 2S 2O x,相对分子质量是190,请计算:
(1)x= ;
(2)焦亚硫酸钠中硫元素与氧元素的质量比是 ;
(3)焦亚硫酸钠中钠元素的质量分数是 (精确到0.1%)
某化学兴趣小组完成了下列两个实验:
实验1:用试管取一定量NaOH溶液,并滴加2滴酚酞溶液,再加入稀盐酸,红色恰好消失。
实验2:用试管取一定量澄清的石灰水,然后加入饱和的Na 2CO 3溶液。
实验结束后,把两支试管里的物质倒入同一烧杯,静置,烧杯中有白色沉淀,上层澄清液显红色。同学们欲对该澄清液成份进行探究,请你参与,完成下列问题:
【问题分析】
(1)实验1的目的是验证 (填化学原理);
(2)实验2中产生白色沉淀的化学方程式 。
(3)澄清液显红色,说明该澄清液显碱性,其中溶质除一定有NaOH外,还可能含有 或 。
【实验验证】
①取澄清液,加入适量的CaCl 2溶液,无明显现象,则澄清液中不含 ;
②取澄清液,通入CO 2气体,产生浑浊,写出产生浑浊的化学方程式 。
【交流反思】化学反应后形成的溶液中溶质的确定,既要考虑反应产物,也要考虑反应物是否过量。
如图是实验室中常见的一些装置,请回答下列问题:

(1)仪器a的名称是 ;
(2)实验室用高锰酸钾制取较纯净的氧气,应选择的发生装置和收集装置是 ;
(3)实验室用石灰石和盐酸制取二氧化碳气体,应选择的发生装置是 ,把产生的气体通入盛有澄清石灰水的试管D中,看到出现气泡,但一直没有出现浑浊,其可能原因是 .
(4)实验室用氢气还原氧化铜,应选择的装置是 ,写出氢气还原氧化铜的化学方程式是 .