铁合金是生产生活中使用最广泛的金属材料,但铁制品容易被腐蚀而在表面生成红褐色的铁锈。为探究铁制品锈蚀的条件,寻找防止铁制品锈蚀的方法,现进行如下实验:
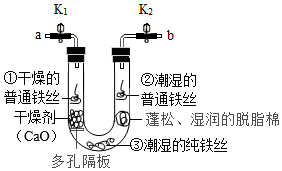
步骤1:利用如 图所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,将导管a、b处的止水夹k1、k2夹紧。
步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。
回答下列问题:
(1)步骤1中,检验U形管内已充满O2的方法是 。
(2)步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有 (填化学式),②处可能观察到的现象是 ,③处没有明显变化,说明纯铁的抗腐蚀能力较 (填“强”或“弱”)。
(3)待U形管内有明显现象后,将b导管插入水中,打开止水夹k2,观察到 现象,说明该条件下铁制品锈蚀过程消耗了O2。
(4)通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁): 。
某种铁合金中含有不溶于酸的杂质。取该合金样品粉末11.4克,分四次向其中加入稀硫酸共200克。反应过程的有关数据记录如下表。
|
次序 |
第1次 |
第2次 |
第3次 |
第4次 |
|
加入稀硫酸的质量/g |
50 |
50 |
50 |
50 |
|
剩余固体的质量/g |
8.6 |
a |
3 |
0.2 |
请回答下列问题
(1)a= 。
(2)原稀硫酸中溶质的质量分数为多少?(请写出计算过程)
孔雀石主要成分为Cu2(OH)2CO3,还含有少量Fe2O3、SiO2(难溶于水,不与酸反应)等杂质。某学习小组探究孔雀石综合利用的流程如图

请回答下列问题:
(1)操作1、操作2均为 操作,此操作中玻璃棒的作用是 和引流。
(2)C中的溶质有:H2SO4、Fe2(SO4)3和 (填化学式)。
(3)步骤②中发生反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3+ 。
(4)写出红褐色沉淀溶于稀硫酸的化学方程 。
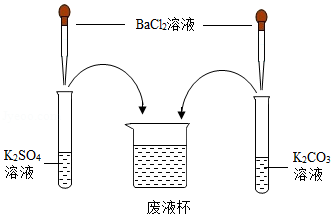
某化学学习小组在学习常见的盐的性质后,完成了如下实验。该学习小组对废液杯上层清液的溶质的成分进行了探究。请完成以下探究过程,并将空白答案填入答题卡相应位置。
[提出问题]上层清液中含有什么溶质?
[作出猜想]Ⅰ溶质仅为 (填化学式);
Ⅱ溶质为KCl和BaCl2
Ⅲ溶质为KCl和 (填化学式);
Ⅳ溶质为KCl和K2CO3
V溶质为KCl、K2SO4和K2CO3
[设计方案]
|
实验操作 |
现象 |
结论 |
|
|
取少量废液缸中上层清液,分装于甲、乙两支试管中 |
先向甲试管中滴加盐酸至过量 |
无明显现象 |
猜想Ⅳ、Ⅴ不正确 |
|
再向乙试管中滴加 溶液(填化学式) |
猜想Ⅱ正确 |
||
[交流反思]学习小组经过讨论认为:实验过程中无须使用AgNO3溶液,其理由是 (用文字表述)
获悉某处矿井中瓦斯报警器发出警报后,学校兴趣小组请求该矿井安全监测人员提供了少量气体样品,进行成分探究。兴趣小组经资料查询,通常瓦斯气体可能含有CO、CO2、CH4等气体。为确定该气体是否含有这三种气体中的一种或几种,小组组长初步设计了如下实验方案供大家讨论:
(已知:CH4+4CuO 4Cu+CO2+2H2O)
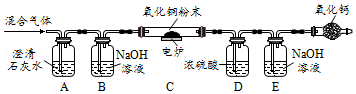
(1)同学甲认为,氧化钙的作用是防止空气中的CO2和H2O对实验造成干扰,小组成员一致同意;
(2)同学乙认为,若装置C中CuO变红,则除了甲烷与CuO可能发生反应外,还可能发生的反应是 (用化学方程式表示);
(3)同学丙认为,欲通过D装置中浓硫酸因吸收水分而增重,说明混合气体中含有CH4的思路不严密,认为需要在 (填序号)间再增加一个D装置(编号为F),才能证明含有CH4;
(4)同学丁认为,B装置可有可无。说说你的看法和理由: ;
(5)同学戊认为,该装置存在着 重大安全隐患,小组成员一致同意。
综合上述讨论,兴趣小组将经过安全处理后的混合气体,通过改进后的装置进行了实验探究,请根据实验现象和数据填写结论:
|
装置 |
实验现象/数据 |
实验结论 |
|
A |
石灰水变浑浊 |
通过实验现象和数据,小组成员一致认为该气体样品中含有 。 |
|
B |
无明显现象 |
|
|
C |
黑色粉末变成红色 |
|
|
D |
装置D增重3.6g |
|
|
E |
装置E增重4.4g |
实验室用高锰酸钾制取氧气,请结合下列装置,回答问题:

(1)写出仪器X的名称: ;
(2)要制备较为纯净的氧气,应选用的发生装置和收集装置是 (填序号),该反应的化学方程式为 ;
(3)该实验的主要步骤有:①将导气管移出水槽;②加热;③装药品、棉花;④收集;⑤熄灭酒精灯;⑥检查装置气密性。正确的操作顺序为 。