MgSO4•7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4•7H2O的主要流程如图:

已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作a”的名称是 。
(2)“废渣Y”中含有少量的 FeOOH,其中铁元素的化合价是 。
(3)MgCO3溶于稀硫酸的化学方程式为 。
(4)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为 。
(5)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是 。
MgSO4•7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4•7H2O的主要流程如图:

已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作a”的名称是 。
(2)“废渣Y”中含有少量的 FeOOH,其中铁元素的化合价是 。
(3)MgCO3溶于稀硫酸的化学方程式为 。
(4)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为 。
(5)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是 。
海水中含有丰富的自然资源,一般是先将海水淡化获得淡水,再通过一系列工艺流程从剩余的浓海水中提取其他产品,从浓海水制取镁的主要反应过程如图所示。
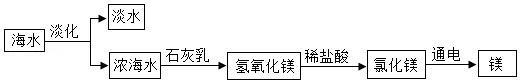
请回答下列问题
(1)用浓海水可以制得粗盐,方法是 。
(2)电解熔融氯化镁的化学方程式为 。
(3)溶解1.16吨氢氧化镁至少需要质量分数为10%的稀盐酸多少吨?请写出计算过程。
为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
【查阅资料】
Ⅰ.20℃时,几种物质在水中的溶解度见下表:
|
物质 |
Na2CO3 |
NaHCO3 |
Ca(OH)2 |
Ba(OH)2 |
|
溶解度/g |
21.5 |
9.6 |
0.165 |
3.89 |
Ⅱ.本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。
【实验探究】
(1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是 ,实验中,小雨采用两只矿泉水瓶做对比实验的目的是 。
(2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2溶液,有白色沉淀产生,该反应的化学方程式为 ,实验中不宜将BaCl2溶液换成CaCl2溶液的原因是 。
(3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈 色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是 。
(4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化,结果如图1、图2所示。

图1中,BC段发生反应的化学方程式为 。
图2中,DE段温度变化的原因是 。
【反思感悟】
(5)实验从CO2减少、NaOH减少,Na2CO3生成等物质的变化,以及 转化等视角多维度探究CO2与NaOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。
探究碳酸氢钠、碳酸钠分别与稀盐酸反应,研究小组进行如下两个实验:
(1)[实验1]同时将足量的稀盐酸倒入锥形瓶甲和锥形瓶乙中。

反应至5s生成气体的速率:碳酸氢钠 碳酸钠(选填“>”,“<”,“=”)。
[实验2]分别将足量的稀盐酸逐滴滴入试管甲和试管乙中,边滴边振荡。

现象为:
①试管甲中的溶液开始时显浅红色,逐滴滴入稀盐酸立即产生大量气泡,浅红色逐渐消失。
②试管乙中的溶液开始时显红色,滴入稀盐酸没有气泡产生,溶液颜色逐渐变为浅红色后,继续滴加稀盐酸有大量气泡产生,浅红色逐渐消失。
(2)[反思1]在[实验2]碳酸钠溶液中逐滴滴入稀盐酸,为何刚开始没有大量气泡产生?研究小组查阅资料,绘制出微观示意图。

①碳酸钠溶液中逐滴滴入稀盐酸,依次发生反应的化学方程式为 、 。
②相同浓度的碳酸氢钠溶液和碳酸钠溶液的碱性:碳酸氢钠 碳酸钠(选填“>”,“<”,“=”)。
(3)[反思2]为何[实验1]中碳酸氢钠最终产生气体的体积较大?
请你列式计算:[实验1]中两种固体完全反应后产生气体的质量各是多少(写出计算过程,结果保留到0.1g)?
(1)控制变量,设计对比试验是实验探究的重要方法。
|
编号 |
实验内容(均在室温环境下进行) |
实验结论 |
||
|
A |
B |
|||
|
① |
|
|
||
|
同时打开A和B装置中分液漏斗的旋塞,观察锥形瓶中反应情况。 |
会影响过氧化氢的分解速率 |
|||
|
② |
|
|
会影响红墨水在蒸馏水中的扩散速率 |
|
|
同时向A和B的烧杯中滴入2滴红墨水,观察烧杯中液体颜色变化快慢。 |
||||
(2)观察是学习化学的重要方法。
研究小组进行如下实验,发现均有红棕色二氧化氮气体产生。
|
[实验1] |
[实验2] |
[实验3] |
查阅资料:4HNO 3  O 2↑+4NO 2↑+2H 2O
O 2↑+4NO 2↑+2H 2O
C+4HNO 3(浓)  CO 2↑+4NO 2↑+2H 2O
CO 2↑+4NO 2↑+2H 2O
①[实验1]中所用碎玻璃与浓硝酸不发生化学反应,灼热的碎玻璃在实验中起到的作用是 。
②[实验2]中有红棕色气体产生,能否证明[实验2]中木炭与浓硝酸发生了反应?请做出判断,并说明理由: 。
③[实验3]中发现红热的木炭表面有红棕色气体产生,且生成的气体产物中检测出二氧化碳(体积分数大于0.03%),能否证明[实验3]中木炭与浓硝酸发生了反应?请做出判断,并说明理由: 。