某小组同学在实验室研究铝与氯化铜溶液的反应,过程如下:
实验操作 |
实验现象 |
|
①铝片表面附着一层红色固体 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色固体和白色沉淀 |
(1)打磨铝片的目的是 。
(2)现象①③中的红色固体是同种物质,请写出现象①的化学方程式 。
(3)经检验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH 7,证实了甲的猜想。
(4)探究现象③中白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
[查阅资料]CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl﹣,Cu(NH3)2+在空气中易被氧化变为蓝色。
[进行实验]①取烧杯底部的白色沉淀,充分洗涤。洗涤的目的是 。
②向白色沉淀中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份,进行实验:
操作步骤 |
实验现象 |
实验结论 |
Ⅰ.用试管取其中一份溶液,滴加适量AgNO3溶液 |
产生白色沉淀 |
该溶液中含有
|
Ⅱ.将另一份溶液置于空气中一段时间 |
|
该溶液中含有Cu(NH3)2+ |
[得出结论]通过实验可以确定,该白色沉淀是CuCl。
[反思与评价]Al和CuCl2溶液反应为什么会出现CuCl呢。
I.丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl.为了验证猜想,他取Cu与15%的CuCl2溶液混合,结果无白色沉淀产生。他又分析了Al和CuCl2溶液反应的实验现象,再次将打磨过的Al片插入盛有15%的CuCl2溶液的试管,并将试管置于冰水中,发现白色沉淀明显减少。于是他将Cu与15%的CuCl2溶液的实验进行了改进,从而证明了Cu与CuCl2溶液反应能生成CuCl,改进的方法是 ,试写出该反应的化学方程式 。
II.丁同学认为丙同学的实验还不够严谨,还应考虑 对Cu与CuCl2溶液反应的影响。
在整理实验室时,同学发现7瓶不同的无色溶液(见如图所示),其中2、3、7号试剂瓶标签完全破损,4、5号试剂瓶标签部分破损。查阅药品记录单可知,2、3、4、5、7号溶液分别是10% NaOH溶液、饱和石灰水、10% Na2CO3溶液、10% CaCl2溶液、10%稀盐酸中的一种。化学小组同学进行了以下实验探究。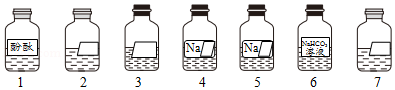
[实验目的]①给试剂瓶贴上正确的标签;②探究部分溶液混合发生的反应。
[查阅资料]①CaCl2溶液呈中性,能与Na2CO3发生复分解反应;
②Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O NaOH+NaHCO3═Na2CO3+H2O
[实验探究]
(1)分别取2、3、4、5、7号溶液于5支试管中,向其中分别滴加1号溶液,发现3、4、5号溶液变红色,说明这3种溶液呈 (填“酸性”、“碱性”或“中性”),由该实验可确定的溶液为 (写出试剂瓶编号及相应的溶液名称);
(2)分别取2号5.55g和7号3.65g溶液,混合均匀后,逐滴加入5号溶液。首先观察到有气泡冒出,然后有沉淀析出。加入5号溶液的质量与产生气体或沉淀的质量关系如图1所示,加入5号溶液的质量与溶液pH的变化关系如图2所示。根据图示完成下列问题:
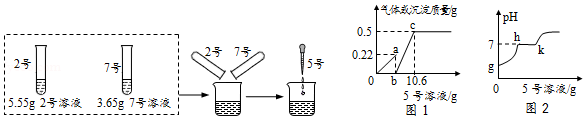
①7号溶液是 (填名称);
②图1中b点数据为 g;
③图2中h→k段发生反应的化学方程式为 。
(3)取3号溶液于试管中,逐滴加入一定量的6号溶液,观察到溶液变浑浊,过滤,则滤液中含有的溶质可能为①NaOH;②Na2CO3;③NaOH、Na2CO3;④NaOH、Ca(OH)2;⑤ 。
[实验反思]分析上述实验,下列说法不正确的是 (填字母序号)。
A.5号试剂可能是部分变质的氢氧化钠溶液
B.该实验无法确定各种试剂,没有完成实验目的①
C.图1中b→c段反应过程中溶液的pH变化情况可用图2中h→k段表示
D.碳酸氢钠既能与碱反应,又能与酸反应
下图是实验室制取气体常用的装置。结合图示回答下列问题:

(1)写出B图中仪器Ⅰ的名称 ;
(2)实验室用加热氯化铵和氢氧化钙固体混合物制取氨气,应选用的发生装置 (填装置字母序号);
(3)实验室利用大理石和稀盐酸反应制取二氧化碳,可选用B发生装置,装置中使用分液漏斗的优点是 ;
(4)实验室用双氧水和二氧化锰制取一瓶干燥的氧气,仪器接口的连接顺序是 (填导管接口的字母序号);
(5)实验室制取CO2一般有六个步骤:①检查装置的气密性;②按要求装配好仪器; ③向漏斗中注入酸液;④向仪器Ⅰ中放入小块的大理石;⑤用燃着的木条靠近集气瓶口验满;⑥收集气体。则正确的操作顺序是 (填数字序号)。
某同学利用“氢气还原氧化铜的实验”测定水的组成。回答下列问题:
(1)用锌粒和稀硫酸反应制取氢气。反应的化学方程式为 ;从下列装置中选择并组装一套可以“随时控制反应的发生与停止”的装置,制取并收集干燥的氢气,正确的连接顺序为 (填接口处字母标号);仪器①的名称是 。

(2)利用如图装置测定水的组成(尾气处理装置及H2验纯等操作均未列出)
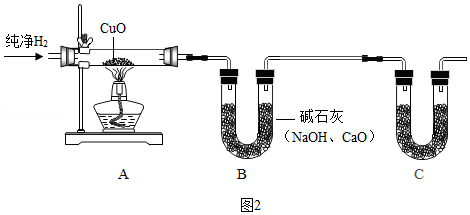
①下列操作的正确顺序为 (填字母序号)。
a.点燃酒精灯 b.通入H2 c.停止通入H2 d.熄灭酒精灯
②装置C的作用是 。
(3)若装置A中的玻璃管和其中的物质在反应前后的质量差为m1,装置B和其中的物质在反应前后的质量差为m2,则水中H、O元素的质量比为 (用含m1、m2的代数式表示)。
铁合金是生产生活中使用最广泛的金属材料,但铁制品容易被腐蚀而在表面生成红褐色的铁锈。为探究铁制品锈蚀的条件,寻找防止铁制品锈蚀的方法,现进行如下实验:
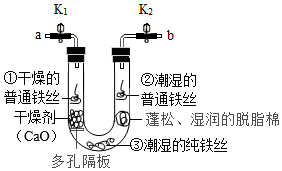
步骤1:利用如 图所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,将导管a、b处的止水夹k1、k2夹紧。
步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。
回答下列问题:
(1)步骤1中,检验U形管内已充满O2的方法是 。
(2)步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有 (填化学式),②处可能观察到的现象是 ,③处没有明显变化,说明纯铁的抗腐蚀能力较 (填“强”或“弱”)。
(3)待U形管内有明显现象后,将b导管插入水中,打开止水夹k2,观察到 现象,说明该条件下铁制品锈蚀过程消耗了O2。
(4)通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁): 。
某化学拓展课堂的主题是:探秘氯化钠样品。
主题Ⅰ:探究氯化钠样品中杂质的成分
已知所提供的氯化钠样品中,可能含有硫酸钠、氯化镁、氯化钙中的一种或几种杂质。甲同学的实验探究过程记录如下:
根据以上实验信息,甲同学得出结论:此氯化钠样品中含有的杂质是硫酸钠。
[实验分析]
(1)步骤①中加入适量NaOH溶液的目的是 。
(2)乙同学认为步骤③中不需要加入足量稀盐酸,你是否同意他的观点? (选填“同意”或“不同意”),请说明原因 。
主题Ⅱ:测定氯化钠样品中氯化钠的质量分数
确定了氯化钠样品中杂质的成分后,甲同学对样品中氯化钠的质量分数进行测定。称取20.0g氯化钠样品于烧杯中,加足量的水充分溶解,再向其中加入氯化钡溶液至不再产生沉淀为止,沉淀经过滤、洗涤、干燥后称量,其质量为2.33g。请计算该样品中氯化钠的质量分数。(写出计算步骤,计算结果精确到0.1%)