向100g硫酸铜与硫酸的混合溶液中加入溶质质量分数为10%的氢氧化钠溶液,溶液质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:
(1)由图象可知,c点溶液中的溶质是 。
(2)当加入氢氧化钠溶液的质量为80g时,所得不饱和溶液中溶质的质量分数是多少?(结果精确到0.1%)

某涂料添加剂M的成分为银、铝、锌中的一种,为确定其成分,取一定质量的M和稀硫酸进行实验。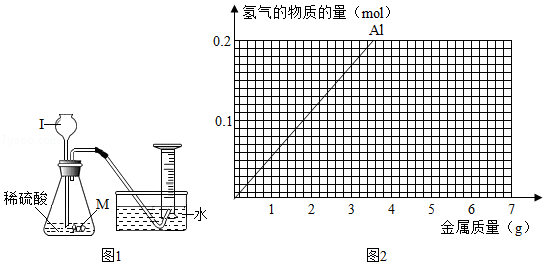
①银、铝、锌的金属活动性由强到弱的顺序是 。
②用如图1方法收集氢气,是因为氢气 (选填“可溶”、“难溶”)于水;仪器Ⅰ的名称是 。
③6.5g锌与足量稀硫酸完全反应,计算产生氢气的物质的量。(根据化学方程式列式计算)
④铝、锌分别与足量的稀硫酸反应。产生氢气的物质的量与消耗铝的质量关系曲线如图2所示,在图中画出产生氢气的物质的量与消耗锌的质量关系曲线。
⑤1.8g样品M与足量稀硫酸完全反应产生0.1mol氢气,则M的化学式是 。
实验室用锌粒与足量稀硫酸反应,制取氢气并还原4.0g氧化铜,实验装置如图(装置气密性良好,夹持仪器省略).

①仪器Ⅰ的名称 ,A中反应的化学方程式是 .
②B中生石灰作 剂;C中反应的化学方程式是 ;D中现象是 .有关的化学方程式是 .
③为确定实验结束后氧化铜是否已基本消耗完,请设计两种不同的方案填入下表.
|
操作 |
判断依据 |
结论 |
|
|
方案一 |
|
|
|
|
方案二 |
|
|
|
如图是实验室制备气体的常用装置和仪器.

①用A制二氧化碳,需要的药品是大理石和 .反应开始后将二氧化碳通入 中,产生白色沉淀.反应一段时间后夹紧弹簧夹,A中现象是 .
②制氧气时,将B与 (选填“C”或“D”)连接组成发生装置.排水法收集满氧气后,用玻璃片 (选填“磨砂”或“光滑”)的一面盖住集气瓶口.
③硫在氧气中燃烧的现象是 .
④若有0.2mol氯酸钾分解,求生成氧气的质量.(根据化学方程式列式计算)
化学兴趣小组为测定某铜锌合金中成分金属的含量,称取10g样品放入烧杯中,向其中加入100g稀硫酸,恰好完全反应后。测得烧杯内所有物质的总质量为109.8g。
请完成下列分析及计算:
(1)反应中共生成气体 g。
(2)计算合金中铜的质量分数。
一种自加热食品包装中加热包的成分有:生石灰、活性炭、铝粉、铁粉、碳酸钠、氯化钙、硫酸镁。使用时需向加热包加水,课堂上老师分别取适量加热包中的固体样品进行如图1实验:
(1)实验A中,将样品加入水里,触摸烧杯外壁发烫,其原因是 。(用化学方程式表示)
(2)实验B中,将一定量稀盐酸加入锥形瓶中,剧烈反应,生成大量气体,学习小组同学对气体成分和锥形瓶内溶液进行探究。
Ⅰ、对气体成分进行探究。
[作出假设]假设一:只有H2,假设二:只有CO2,假设三:H2和CO2。
[实验验证]小明同学设计如图2实验,对气体成分进行探究。

①当气体通过甲时,澄清石灰水变浑浊,证明假设 不成立。
②丁中出现 的现象时,证明假设三成立。
③乙的作用是 。
Ⅱ、对锥形瓶内的溶液进行探究。
实验后,小萍同学取少量锥形瓶内的溶液于试管中,向其中滴加NaOH溶液,开始一段时间无沉淀生成,其原因是锥形瓶内的溶液中存在 。
[总结反思]通过以上探究,小林同学做了如下的反思归纳:
a.加热包应密封防潮保存
b.向用过的加热包内的固体中,加入过量稀盐酸后过滤,可以回收活性炭
c.能与水混合放出热量的物质均可用作加热包中的发热材料
你认为其中不正确的是 (填字母)