金属是重要的资源,与我们的生活息息相关。请回答下列问题。
(1)将黄铜片和铜片相互刻画,铜片上留下划痕,说明黄铜的硬度比铜的硬度 (填“大”或“小”)。
(2)铁制品锈蚀极大程度上浪费了金属资源,写出一种防止铁制品锈蚀的方法: ;为了保护金属资源,除防止金属的腐蚀外,还可以采取的措施有 (写一条即可)。
(3)将一定量的锌粒放入硝酸银和硝酸铜的混合溶液中,充分反应后,过滤,得到滤渣和滤液。若滤液为无色,则滤渣中一定含有 ;若滤液为蓝色,则滤液中溶质的成分一定含有 。
某中学本学期对校园垃圾实行了分类回收,他们回收的三类废弃物:A、废纸B、塑料瓶C、易拉罐及废旧铝合金门窗,都得到了很好的利用。
(1)用字母A、B、C填空:属于有机合成材料的是 ,属于金属材料的是 。
(2)铝合金门窗比纯铝 (填"更硬"或"更软")。
(3)学校学生会对本学期每周回收塑料瓶的个数做了统计,统计结果如下图所示。
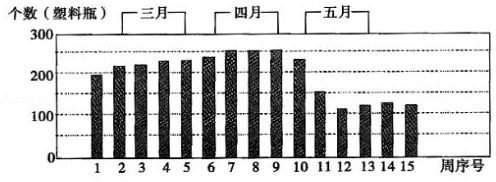
学生会在第十周组织了一次"使用塑料瓶的利与弊"的辩论会。以下三个论点,你认为正确的是 (填字母)。
A.塑料的制造成本较低,耐用,但不防水
B.塑料容易被塑制称不同的形状
C.有些塑料容易燃烧,燃烧产物不会污染环境
(4)辩论会结束后,学校每周回收塑料瓶的总数明显减少,请从同学们的日常行为上分析,指出其中一个原因 。
某化学兴趣小组用一定浓度的稀盐酸和含杂质5%(杂质不与盐酸反应)的石灰石制备CO2,他们选择的制取和收集装置如图所示。请按要求回答问题和探究:
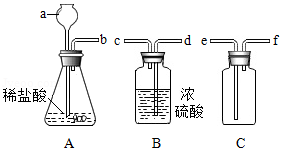
(1)装置A中仪器a的名称是 ,若要制取并收集干燥的CO2,导管的连接顺序是 。
(2)若消耗的石灰石为100g,理论上可得到CO2 g(精确到0.1),但实际收集到的CO2质量与理论值不符,原因可能是 (填一种)。
(3)探究装置A中残留液的溶质成分。
【提出问题】残留液中含有哪些溶质?
【查阅资料】CaCl2溶液呈中性。
【思考判断】残留液中一定含有的溶质是 (填物质名称),可能含有的溶质是HCl。
【实验验证】同学们通过多种实验方法,均验证了残留液中的溶质有HCl,请完成下表。
|
实验操作 |
现象(数据或化学方程式) |
结论 |
|
|
方法一 |
用酸碱指示剂测定溶液的酸碱性,所选择的指示剂为 。 |
现象: |
残留液中的溶质有HCl |
|
方法二 |
用pH试纸测定溶液的pH。 |
pH 7 (填>、=或<) |
|
|
方法三 |
用化学药品检测,且发生了复分解反应,可能选用的药品为 (填一种物质的化学式)。 |
现象: 化学方程式:
|
为测定某溶液中氢氧化钠的质量分数。某同学取50g氢氧化钠溶液与50g硫酸铜溶液混合,恰好完全反应。过滤,所得滤液的质量为90.2g。
求(1)反应后生成沉淀的质量为 g
(2)50g氢氧化钠溶液中溶质的质量分数。
某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取5g样品,加入27g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH=7时,刚好用去10%的稀盐酸36.5g,试计算:
(1)将100g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量为 g。
(2)样品中氢氧化钠的质量分数。
(3)反应后所得溶液中溶质的质量分数。
钙是人体必须的常量元素,葡萄糖酸钙(C12H22O14Ca)是一种常用的补钙剂.
(1)葡萄糖酸钙中碳、氢元素的质量比为 .
(2)葡萄糖酸钙中钙元素的质量分数比为 (保留一位小数).