实验室有一瓶久置的氢氧化钠固体,经检验只含有NaOH和Na2CO3两种物质。现取该固体样品12.5g溶于水配制成溶液。然后向溶液中滴加稀硫酸,同时收集反应产生的气体。当溶液中的溶质恰好全部转化成Na2SO4时,立即停止滴加稀硫酸。将产生的气体干燥后测定其质量为2.2g(假定溶液中无气体残留)。回答下列有关问题:
(1)写出碳酸钠与硫酸反应的化学方程式: 。
(2)氢氧化钠固体样品中NaOH的质量为 。
(3)计算所加稀硫酸的体积(稀硫酸的溶质质量分数为40%,密度为1.3g/cm3)。
[要求:第(3)小题写出计算过程且计算结果保留到小数点后1位]
文文想通过实验测定稀盐酸的溶质质量分数,他分四次向182.5g稀盐酸中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的质量如下表所示:
|
次数 |
1 |
2 |
3 |
4 |
|
锌粉质量/g |
5 |
5 |
5 |
5 |
|
氢气质量/g |
0.15 |
0.15 |
0.1 |
0 |
请帮文文计算稀盐酸的溶质质量分数。
有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200g,平均分五次加入其中,充分振荡,实验所得数据如下表:
|
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
|
加入稀盐酸的质量/g |
40 |
40 |
40 |
40 |
40 |
|
生成气体的总质量/g |
0.16 |
m |
0.48 |
0.5 |
0.5 |
(1)表中m的值为 。
(2)所用稀盐酸的溶质质量分数为多少?
实验室有一瓶含杂质的氯酸钾。某兴趣小组利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如图:

请回答下列问题:
(1)a= 。
(2)计算受热分解的氯酸钾的质量(精确到0.1g)。
现有一种稀盐酸和氯化铝的混合溶液,取100g该溶液于烧杯中,向其中逐滴加入氢氧化钾溶液,至氯化铝正好完全转化为沉淀,停止滴加氢氧化钾溶液,经测定,生成沉淀的质量为7.8g。请回答:
(1)据观察,产生沉淀前,消耗了一定量的氢氧化钾溶液,请写出该反应的化学方程式 。
(2)100g混合溶液中氯化铝的质量分数是多少?(写出计算过程,计算结果精确到小数点后两位。产生沉淀的化学方程式:AlCl3+3KOH=Al(OH)3↓+3KC1)
科学探究是学习化学重要而有效的学习方法。某校化学兴趣小组的同学做实验,向盛有少量NaOH溶液的试管中通入CO2,未看到明显的实验现象。同学们对NaOH与CO2能否反应进行验证,并对废液的成分进行探究。
活动一
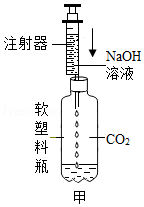
同学们经过讨论,设计了甲装置并进行实验,请你把实验现象补充完整。
|
实验步骤 |
实验现象 |
猜测 |
|
如图甲,向集满二氧化碳的软塑料瓶中滴加足量的氢氧化钠溶液,振荡 |
|
①CO2溶于NaOH溶液中 ②CO2与NaOH反应 |
活动二
兴趣小组的同学对猜测②进行如下探究实验
(1)取软塑料瓶中的液体于三支试管中,三位同学分别完成如图所示实验。
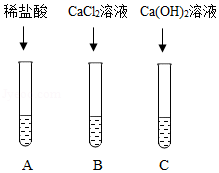
(2)同学们观察到A试管中有气泡冒出,B、C试管中均有白色沉淀生成。请你写出A试管中生成气体的化学反应方程式 。
(3)以上三个实验均能证明CO2与NaOH发生了反应。请写出甲装置中发生反应的化学方程式 。
活动三
实验结束后,同学们将三支试管中反应后的剩余物倒入一个洁净的大烧杯中(如图),充分搅拌、静置,观察到烧杯内上层是无色溶液,下层有白色沉淀。请你分析烧杯上层溶液中一定不含有的离子是 (填离子符号)。小组同学对烧杯内上层溶液中可能含有的离子进行如下探究。
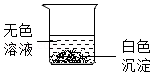
[提出问题]烧杯内上层溶液中可能含有哪些离子?
[猜想与假设]上层溶液中可能含有OH﹣、CO32﹣、Ca2+中的一种或几种。
[进行实验]
|
实验步骤 |
实验现象 |
实验结论 |
|
①取烧杯内无色溶液少许于试管中,滴加 滴加过量的氯化钙溶液 ,静置 |
有白色沉淀生成 |
有CO32﹣、无Ca2+ |
|
②取①中反应后的上层清液少许于试管中,滴加 硫酸铜溶液 (指示剂除外) |
蓝色沉淀生成 |
有OH﹣ |
[反思评价]
(1)经过综合分析,最终确定烧杯内上层溶液中一定存在的离子有 (填离子符号)。
(2)将烧杯内的物质过滤,滤渣回收,向滤液中加入适量的 (填名称)进行处理后再排放,可以有效防止水体污染。