在《探究酸、碱的化学性质》实验课上,某同学向盛有约2mL氢氧化钠溶液的试管中滴加稀硫酸,没有观察到现象。请教老师后,他发现自己在滴加稀硫酸前忘了加入酸碱指示剂,导致无法判断反应情况,于是他对试管中溶液的中和程度进行探究。
[探究目的]探究试管中溶液的中和程度。
[实验原理]试管中发生反应的化学方程式为 。
[做出猜想]猜想l:氢氧化钠未完全反应,溶液呈碱性。
猜想2:氢氧化钠和硫酸恰好完全反应,溶液呈中性。
猜想3:氢氧化钠完全反应、硫酸过量,溶液呈酸性。
[进行实验]
实验操作 |
实验现象 |
实验结论 |
另用试管取该溶液1~2mL,滴入1~2滴无色酚酞溶液,振荡 |
溶液变 |
溶液呈碱性 |
溶液不变色 |
溶液呈酸性或中性 |
[分析思考](1)若溶液呈碱性,向试管里的溶液中逐滴加入FeCl3溶液,将产生红褐色沉淀,反应的化学方程式为 。
(2)若滴入酚酞后溶液不变色,为进一步确定溶液的酸碱性,该同学提出了以下方案:
方案1 |
用pH试纸测其酸碱度,若pH 7(选填“>”“<”或“=”),则溶液呈酸性 |
方案2 |
加入金属锌,若有气泡产生,则溶液呈酸性,该反应的化学方程式为 。 |
生活中处处有化学,化学与生活密切相关.
(1)铝常用于制作导线,因为其具有良好的 .
(2)将纯铜片和黄铜片(铜锌合金)相互刻画,纯铜上留下明显划痕,说明 .
(3)胃酸里含有适量盐酸,服用含氢氧化铝[Al(OH) 3]的药物可治疗胃酸过多症,反应的化学方程式为 .
(4)幼儿及青少年缺少 元素可引发佝偻病和发育不良.
(5)农作物种植过程中可以施用下列化肥,其中属于复合肥料的是 (填序号)
A.NH 4HCO 3 B.KCl C.NH 4H 2PO 4.
为测定一标签破损(如图)的钙片中碳酸钙的含量,某同学做如图实验:取10片钙片,放入干燥、洁净的烧杯中,然后逐滴滴加稀盐酸,当加入50g盐酸后,恰好完全反应,此时称量烧杯内剩余物质的总质量为65.6g(钙片中其他成分不和稀盐酸反应,反应中产生的气体全部放出).
(1)反应中生成 g二氧化碳,该钙片中碳酸钙的质量分数为 ;
(2)试计算所用稀盐酸中HCl的质量分数.

做完氢氧化钠与稀硫酸中和反应的实验后,兴趣小组的同学对反应后溶液中溶质的成分进行了探究,请和他们一起探究并完成以下各空;
[提出问题]溶液中溶质的成分是什么?
24;
24和 两种物质;
24和NaOH两种物质。
[实验验证]
|
实验操作 |
实验现象 |
实验结论 |
|
|
甲同学实验 |
取适量中和反应后的溶液滴于试管中,将表面打磨后的铝片放入试管的溶液中 |
铝片逐渐溶解,并有大量气泡冒出 |
猜想(2)成立 |
|
乙同学实验 |
取中和反应后的溶液少许于另一试管中,并滴加几滴无色酚酞试液 |
溶液变 色 |
猜想(3)成立 |
丙同学对甲、乙两同学结论不同产生质疑。
242)和氢气,反应的化学方程式为2Al+2NaOH+2 H2O 22↑。
[交流反思]①丙同学肯定猜想(1) (填“成立”或“不成立”);
②丁同学认为猜想(2)不成立,其理由是 ;
③该组同学经过充分讨论,一致认为猜想(3)成立;
④甲同学的实验是铝片和 溶液反应。
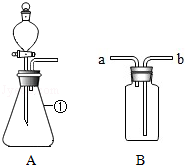
通过近一年的化学学习,你已经掌握了实验室制取气体的有关方法,请根据图回答问题:
(1)仪器①的名称是 2和 ;
(2)连接好装置后,必须首先 ;
(3)用排水法收集氧气,可在B装置中装满水后,是氧气从 口进入(填“a”或“b”);应将收集满氧气的集气瓶正放在桌面的原因是 .
已知某溶液中的溶质可能是HCl、NaOH、CaCl 2中的一种或两种,为确定该溶液中溶质的成分及含量,进行以下实验。
(1)取少量溶液与试管中滴入2滴无色酚酞,酚酞不变色,溶液中一定不存在 。
(2)为了进一步测定成分及含量,重新取120g溶液于烧杯中,逐滴加入20.0%的Na 2CO 3溶液,测得滴加溶液的质量与产生沉淀的关系(图1)和滴加溶液的质量与烧杯中溶液的pH关系(图2)。
(已知:向盐酸中滴加碳酸钠溶液发生反应为:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑;CaCl 2溶液呈中性。)回答下列问题:

①该溶液中溶质的化学式为 。
②计算溶液中各溶质的质量分数。(写出计算过程)
③m 1= g;m 2= g。