某化学兴趣小组做粗盐提纯实验,并对粗盐的成分作进一步探究。请回答下列问题:
实验一:粗盐提纯
(1)提纯实验多次用到了玻璃棒,请写出该实验中使用玻璃棒的一个作用① ;
(2)蒸发后所得食盐质量② (读数见图)。
实验二:物质检验
[提出问题]食盐中除含有NaCl外,可能还含有什么溶质?
查阅资料一]食盐中可能还含有Na2CO3、Na2SO4等。
[作出猜想]猜想一:含有溶质Na2CO3;
猜想二:含有溶质Na2SO4;
猜想三:③ 。
[查阅资料二]Na2CO3溶液、Na2SO4溶液均可以与BaCl2溶液反应生成白色沉淀,且BaCO3可以溶于盐酸,BaSO4不能溶于盐酸。
[讨论交流]小组同学经讨论后认为:选择BaCl2溶液和稀盐酸两种试剂即可验证猜想。若猜想二正确,则发生反应的化学方程式为④ 。
[实验验证]为验证猜想,小组同学设计了如下实验方案。
Ⅰ.取上述食盐样品少量于试管中,加水溶解,得到澄清透明溶液;
Ⅱ.向溶液中滴加过量的BaCl2溶液,生成白色沉淀,静置;
Ⅲ.静置后弃去清液,加入足量稀盐酸,发现沉淀部分溶解,且有气泡产生。
[实验结论]根据上述实验现象判断⑤ 是正确的(填“猜想一”、“猜想二”或“猜想三”)。
[问题与交流]小组同学在实验报告中记录了如下文字:经实验验证,该食盐样品中仅含有NaCl、Na2CO3和Na2SO4,你认为这个观点⑥ (填“正确”或“错误”)。请说明你选择的理由⑦ 。

过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑。
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在如图中画出产生氧气的曲线图。
(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:
|
物质 |
相对分子质量 |
纯度 |
价格(元/kg) |
|
Na2O2 |
78 |
98% |
25 |
|
CaO2 |
72 |
94% |
24 |
用3000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2(已知用3000元购买过氧化钙样品可制得26.1kg O2)?

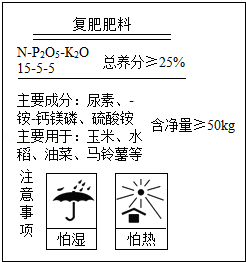
某复合肥的部分说明书如图所示。请回答:
(1)从肥效的角度看,共有种有效元素 。
(2)该复合肥的有效成分之一是尿素[CO(NH2)2],则尿素中碳、氧、氮、氢的原子个数比为 。
(3)一袋该化肥至少含P2O5 kg。
(4)从“注意事项”看,该复合肥料的物理性质是 ,化学性质是 (写一种)。
根据图1回答有关问题.

(1)仪器E的名称为 .
(2)图A~C是常见实验基本操作.其中正确的是 (填序号);请选择一个有错误的操作写出改正方法: .
(3)选择仪器D~I完成下列实验操作:
①用KMnO4制备O2,应选仪器 (填序号),其化学反应方程式为 ;
②用大理石与稀盐酸反应制备CO2并使反应随时发生或停止,应选仪器 ,
其反应方程式为 .
(4)图2是以锌粒和稀硫酸反应制备H2,并用排水法收集.请把图补画完整.

小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜Cu(OH)2═CuO+X,于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为 。
(2)制取氢氧化铜的化学方程式为 。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
[查阅资料]Cu和Cu2O均为红色固体,且Cu2O+H2SO4═Cu+CuSO4+H2O。
[提出猜想]红色固体是:Ⅰ.CuⅡ.Cu2OⅢ. 。
[进行实验]
|
操作 |
现象 |
结论 |
|
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 |
溶液由无色变蓝色,固体减少。 |
1.44g红色固体一定有: |
|
②过滤、洗涤、干燥。 |
得红色固体 |
[结论分析]
①据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想 也有相同现象。
②氧化铜高温灼烧由黑色变成红色的化学方程式为: 。
③如要确定1.44g红色固体成分,还需要补充的操作是 ,再通过 得出结论。
甲班学生做完实验室制备氧气和还原金属氧化物的实验后,剩余物质倒入同一废液缸里。乙班课外兴趣小组同学进行了如图所示的探究。(二氧化锰在常温下不和酸反应)请回答:

(1)步骤①的操作名称是 ,所用到的玻璃仪器有漏斗、玻璃棒和 。
(2)由步骤②实验现象推知,甲班同学制取氧气所用的固体反应物是 (写化学式)。
(3)由步骤④所得溶液加入氢氧化钠可得红棕色沉淀,该反应的化学方程式为 。
(4)由步骤③产生的气体判断固体A中一定含有 (写名称);综合步骤③④现象推理,固体A中还可能含有的物质是 (写至少两种物质的化学式)。
(5)根据上述实验和分析判断固体C是 (写化学式)。