现有含杂质氯化镁的氯化钾,欲除去杂质,配制氯化钾溶液,操作流程见图1。

请回答下列问题:
(1)加入氢氧化钾溶液,反应的化学方程式是 。
(2)过滤。有关过滤操作的叙述不正确的是 (填写字母标号)。
A.用少量水润湿滤纸,并使滤纸与漏斗壁之间留有气泡
B.漏斗下端的管口要紧靠烧杯内壁
C.玻璃棒要靠在三层滤纸的一边
D.滤纸边缘要低于漏斗口,液面要低于滤纸边缘
(3)蒸发。把液体倒入蒸发皿,进行加热,在加热过程中,用玻璃棒不断搅拌,目的是 。

(4)天平调零。如图2示,先把游码移至零刻度线处,如果指针静止时偏向右侧,则应该把右端的平衡螺母往 旋动(填写"左"或"右")。
(5)配制溶液。称量氯化钾固体的质量和量取水的体积时,天平示数(单位:克)和量筒读数(单位:毫升)分别如图4示,则所配氯化钾溶液中溶质的质量分数是 。(水的密度可近似看做1g/cm 3)
(2013云南昆明)人教版新课标化学教材九年级上册(2012教育部审定)“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【实验探究】
| 实验步骤 |
实验现象 |
| Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 |
A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象。 |
试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得虑渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
| Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末.向D试管中加入ag二氧化锰粉末,观察现象。 |
【实验结论】
(1)A中产生的气体是 ;
(2)实验Ⅱ、Ⅲ证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的化学方程式 。
【实验评价】
(1)设计实验Ⅳ的目的是 ;
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
【实验拓展】
查阅资料得知:CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂,下列有关催化剂的说法中正确的是 。
A.MnO2只能作为氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.用作催化剂的物质不可能是其它反应的反应物或生成物
E.酶是一种重要的生物催化剂,它属于糖类
某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色.请看图回答问题:
(1)A中反应的化学方程式 ;B中白磷不燃烧,原因是 .
(2)C、D中看到的现象分别是 、 .
(3)用化学方程式表示E中颜色变化的原因 ;用F装置收集气体的依据是 .
同学们在实验室用5%的H2O2溶液制取氧气并进行氧气性质实验。
溶液配制:用50ml 30%的H2O2溶液制取氧气(密度为1.13g/cm3)配制5%的H2O2溶液(密度约为1g/cm3)。溶液配制过程中,除用到玻璃棒外还需用到下列仪器中的_____________。
| A.托盘天平 |
| B.烧杯 |
| C.漏斗 |
| D.量筒 |
E.胶头滴管
气体制备:用配制好的5%H2O2溶液和MnO2制取O2。请你在“A”、“B”两套装置中选择其中一套,并说明选择的理由_____________________,该反应的化学方程式为________________________。待反应结束后同学们回收了混合物中的MnO2,实验操作为____________________。
性质实验:小明用收集好的氧气,进行了下面的实验:
把点燃的木炭伸入集气瓶中,实验现象是_______________________;为使铁丝在氧气中持续剧烈燃烧,他把光亮的细铁丝盘成螺旋状,_____________________________________,缓慢插入集气瓶中,观察到持续剧烈燃烧。通过实验得出,氧气可以支持燃烧,并且可燃物燃烧更剧烈。
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序.
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合弹的方案,如图l所示: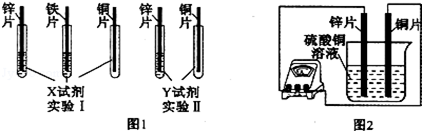
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现青色.
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至 色,最终变为无色;
B.向混合注中插人锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
② ;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表 ;②铜片表面 .
(2013湖北宜昌)二氧化硫是造成酸雨的主要物质之一。小丽为探究二氧化硫能与水反应生成酸,设计了如下实验方案。
【实验设计】她先用紫色石蕊溶液将白色滤纸浸润,干燥后做成紫色的小花,然后按下列图示进行实验。观察到实验(Ⅰ)和(Ⅲ)中的小花变红,(Ⅱ)中的小花不变色。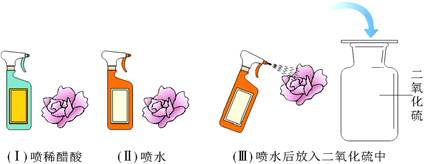
【评价反思】小虎对小丽的实验方案提出了质疑,他认为上述实验还不足以证明“二氧化硫和水反应生成了酸”。两位同学仔细讨论后认为还需补充如下一个实验,才能得出二氧化硫与水反应生成酸。
| 实验操作 |
实验现象 |
| |
【拓展应用】二氧化硫也是实验室一种污染气体,常用碱液吸收。写出实验室用氢氧化钠溶液吸收二氧化硫的化学方程式: 。