为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
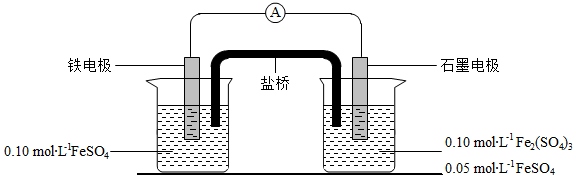
回答下列问题:
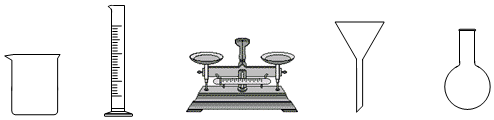
(1)由FeSO 4•7H 2O固体配制0.10mol•L ﹣ 1FeSO 4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择 作为电解质。
阳离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
阴离子 |
u ∞×10 8/(m 2•s ﹣ 1•V ﹣ 1) |
Li + |
4.07 |
HCO 3 ﹣ |
4.61 |
Na + |
5.19 |
NO 3 ﹣ |
7.40 |
Ca 2+ |
6.59 |
Cl ﹣ |
7.91 |
K + |
7.62 |
SO 4 2 ﹣ |
8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe 2+)增加了0.02mol•L ﹣ 1.石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe 2+)= 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极反应式为 。因此,验证了Fe 2+氧化性小于 ,还原性小于 。
(6)实验前需要对铁电极表面活化。在FeSO 4溶液中加入几滴Fe 2(SO 4) 3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是 。
甲同学设计如图所示装置研究氯气能否与水发生反应。
气体a的主要成分是含有少量空气和水蒸气的氯气。请回答下列问题:
(1)浓硫酸的作用是。
(2)实现实验目的实验现象为 。
。
(3)装置C中发生反应的离子反应方程式为_________________________________。
(4)乙同学 认为甲同学的实验不符合“绿色化学”的要求,若要使实验符合要求,应在装置_________(填写装置代号)后面添加装置。
认为甲同学的实验不符合“绿色化学”的要求,若要使实验符合要求,应在装置_________(填写装置代号)后面添加装置。
实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列实验操作,错误的是________________ ____(填写序号)。
____(填写序号)。
a. 用纸槽往试管里装粉末状药品时,试管应先横放再直立
b. 称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c. 试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d. 用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需要450mL 0.1mol·L-1NaOH溶液和500mL 0.5 mol·L-1硫酸溶液。请回答下列问题:
①在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有。
②在容量瓶的使用方法中,下列操作正确的是____________(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水。
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
③配制450 mL 0.1mol·L-1 NaOH溶液的实验步骤如下:
a.计算 应称取氢氧化钠固体的质量为________g。
应称取氢氧化钠固体的质量为________g。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容
量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞 ,反复上下颠倒,摇匀。
,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与
刻度线相切。
上述步骤的正确操作顺序为_______________________(用序号表示)。
④根据计算得知,需用 量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
mL,如果 实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。
实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。
(12分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式
;
②试验装置用下列所有仪器连接而成,其中D、E可重复使用。按氢气流方向的连接顺序是(填入各仪器相应字母,如果认为必要可以补充):
A→()→()→()→()→() →F
③E装置的作用是___________________,E中的药品最好是______________
A.水 B.饱和碳酸钠溶液 C.饱和碳酸氢钠溶液 D.氢氧化钠溶液
④称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为g,化学式为;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?_______(填“可行”或“不可行”)如果可行写出反应的化学方程式:(认为不可行此空可不填)。
(12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。
(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是_______________。
(3)已知有反应:Cu2O+2H+ Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了e g,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄 色的物质是:(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是。
色的物质是:(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是。
(2)现提供以下试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 | D.硫氰化钾溶液请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。 |
| 同学正确 |
选用试剂 |
实验现象 |
| 第一种方法 |
||
| 第二种方法 |