石灰石是重要的化工原料。为研究石灰石的性质和用途进行如下探究。
Ⅰ.石灰石分解的探究
取三块形状大小相近的石灰石(长宽厚约为1cm×1cm×0.2cm),一块不加热,另两块分别在酒精灯和酒精喷灯(酒精化学式为C2H5OH)的火焰上加热2min(假设杂质加热时不发生变化)。探究过程如图所示,实验现象见表1。
表1 不同条件下的实验现象
实验组别 |
实验条件 |
试管B中的现象 |
甲 |
未加热 |
无明显现象 |
乙 |
酒精灯加热 |
呈浅红色 |
丙 |
酒精喷灯加热 |
呈红色 |

(1)通过甲、乙、丙三组对比实验,得出影响石灰石分解的因素是 。
(2)丙组实验加热石灰石时,在火焰上方倒扣一个用澄清石灰水润湿的烧杯,石灰水变浑浊,出现浑浊的化学方程式为 。此实验能否推断石灰石煅烧产生二氧化碳,并说明理由: 。
(3)丙组实验中,向试管B中逐滴滴入稀盐酸,至红色恰好褪去,轻轻晃动试管,溶液自下而上又变为红色。解释产生上述现象的原因: 。
(4)为检验丙组实验中的石灰石部分分解,设计实验:取研细后的粉末少许于试管中,
(补充完整实验方案)。
Ⅱ.石灰石煅烧温度的探究
【查阅资料】生石灰质量的优劣常采用“活性度”来街量。“活性度”的测定方法:取一定质量的生石灰,加入一定量的水,用指定浓度的盐酸中和,记录所消耗盐酸的体积数(单位为mL)。消耗盐酸的体积数越大,“活性度”越高。
某研究小组在电炉内煅烧石灰石样品,并测定煅烧产物(CaO)的活性度,数据见表2。
表2 不同条件下煅烧产物的活性度(mL)
煅烧时间/活性度/煅烧温度 |
1050℃ |
1100℃ |
1150℃ |
1200℃ |
1250℃ |
1300℃ |
12min |
790 |
836 |
868 |
808 |
454 |
412 |
16min |
793 |
856 |
871 |
845 |
556 |
530 |
20min |
795 |
863 |
873 |
864 |
617 |
623 |
(5)石灰石煅烧的最佳温度范围为1100~1200℃的证据是 。
Ⅲ.石灰石用途的探究
(6)石灰石是高炉炼铁的原料之一。石灰石能除去铁矿石中的SiO2,同时能提高单位时间内生铁的产率。分析加入石灰石能提高生铁产率的原因: 。
小林在凉拌紫卷心菜时,加入一些食醋,发现紫卷心菜变红了,这激发了他的探究欲望,特邀你协助完成下列活动与探究。
【提出问题】紫卷心菜等植物的汁液能作酸碱指示剂吗?
【实验探究】取紫卷心菜、牵牛花的花瓣、胡萝卜,分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1∶1)浸泡,用纱布将浸泡出的汁液挤出,分别加入到蒸馏水、稀酸溶液和稀碱溶液中,有关颜色变化情况如下:
| 汁液 |
在不同液体中的颜色变化 |
||
| 蒸馏水 |
稀酸溶液 |
稀碱溶液 |
|
| 紫卷心菜 |
蓝紫色 |
红色 |
绿色 |
| 牵牛花 |
紫色 |
红色 |
蓝色 |
| 胡萝卜 |
橙色 |
橙色 |
橙色 |
【得出结论】、的汁液能作酸碱指示剂,的汁液不能作酸碱指示剂。
【拓展应用】小林用上述的牵牛花汁液来测定某雨水样品的酸碱性,发现牵牛花汁液呈红色。则该雨水呈性(选填“酸”“碱”或“中”)。
【反思与评价】小林发现,上述汁液无法测出溶液的酸碱度,请你告诉他,在实验室测定溶液的酸碱度常用。
学习了氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞试液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞试液变红色。
【提出猜想】猜想①:可能是H2O ;猜想②:可能是Na+;猜想③:可能是OH-。
【实验验证】
| 实验操作 |
实验现象 |
结 论 |
| ①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞试液,振荡 |
试管内溶液仍为无色 |
水分子不能使无色酚酞试液变红色 |
| ②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 |
||
| ③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 |
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是。
某兴趣小组的同学在老师的指导下,对一瓶没有塞橡皮塞的氢氧化钙溶液进行探究,请你一起参与。
【提出问题】该氢氧化钙溶液是否全部变质?
【猜想与假设】猜想①:氢氧化钙溶液可能全部变质,变成碳酸钙。
猜想②:氢氧化钙溶液可能部分变质,其成分是。
【实验探究】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取样于试管中,滴加稀盐酸,充分振荡 |
有生成 |
原溶液中一定含有碳酸钙 |
| (2)另取样于试管中,滴加酚酞试液 |
溶液呈红色 |
原溶液中含有 |
【实验结论】综合上述实验(1)、(2),你得出的结论是猜想成立。
【反思与拓展】(1)氢氧化钙露置于空气中容易变质,原因是(用化学方程式表示)。
(2)在分析化学反应后的物质成分时,除了考虑生成物外,还需考虑的是。
在学习碱的性质时,为了验证溶液中的氢氧化钠能与二氧化碳反应,老师做了下面两个实验。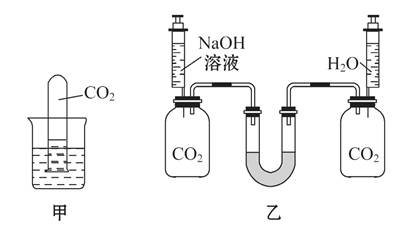
实验一:如图甲,将一支充满二氧化碳的试管倒扣在盛有氢氧化钠溶液的烧杯中,观察试管中的液面变化情况。
实验二:如图乙,向两个装满二氧化碳的同样规格的瓶中分别注入等量的氢氧化钠溶液和蒸馏水,振荡后放在水平的桌面上,观察U形管(装有红墨水)两端液面的变化情况。请问:
(1)实验二中若观察到U形管左端的液面(填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应。
(2)与实验一相比,同学们认为实验二更合理,因为它能排除对实验的干扰。
某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石与稀盐酸制取),对反应后反应器中剩余溶液的溶质成分产生了兴趣。他们继续进行了如下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙,但其中是否含有氯化氢需要通过实验来证明。若剩余溶液显酸性(含有
H+),说明含有氯化氢。
【查阅资料】碳酸钙不溶于水,氯化钙溶液不显酸性。
【实验过程】
将剩余溶液倒入烧杯中,微热后冷却至室温。
| 实验操作 |
实验现象 |
实验结论 |
|
| 甲同学 |
取烧杯中溶液少许于试管中,向其中滴加 |
现象:溶液变为红色 |
溶液显酸性(含有H+),溶质中有氯化氢 |
| 乙同学 |
取烧杯中溶液少许于试管中,向其中加入少量锌粒 |
现象: 反应的化学方程式是: |
|
| 丙同学 |
取烧杯中溶液少许于试管中,向其中加入少量石灰石 |
现象: |
【拓展提高】若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的(填化学式),经,蒸发等操作后即可完成。