实验室贮存的镁条表面有一层灰黑色的物质,用砂纸打磨后发现镁是一种银白色的金属。镁在空气中燃烧发出耀眼的白光,生成白色的氧化镁固体。某化学实验小组对镁条表面的灰黑色物质产生了兴趣,并对其成分进行如下探究。
【提出问题】镁条表面的灰黑色物质是什么?
【猜想与假设】同学们根据空气的成分对镁条表面的灰黑色物质提出以下猜想:
猜想一:是MgO
猜想二:是
猜想三:是
猜想四:是
实验小组的小军同学认为灰黑色物质是氧化镁,但是遭到了其他同学的一致反对,
【设计实验】
|
实验序号 |
实验操作 |
实验现象 |
分析与结论 |
|
实验Ⅰ |
取一定量的灰黑色物质于试管中,滴加稀盐酸,将生成的气体通入澄清石灰水 |
试管中固体溶解,有气泡产生。生成的气体使澄清石灰水变浑浊 |
生成的气体是
|
|
实验Ⅱ |
另取一定量干燥的灰黑色物质于试管中,加热,将生成的气体依次通过无水硫酸铜和澄清石灰水 |
一段时间后,试管中的灰黑色物质变为白色,无水硫酸铜变为蓝色,澄清石灰水变浑浊 |
无水硫酸铜变为蓝色,说明产物中一定有 |
【结论与反思】
(1)写出实验Ⅰ中澄清石灰水变浑浊的化学方程式 。
(2)根据实验Ⅰ、Ⅱ的现象和结论,猜想 是正确的。
(3)写出实验Ⅱ中灰黑色物质受热分解的化学方程式 。
【拓展与提升】
镁条表面的灰黑色物质是镁与空气中的氧气、 共同作用,发生一系列化学反应形成的。为了防止镁条表面形成灰黑色物质,工业上往往将镁和铝制成合金。现有一块21g的镁铝合金与足量的稀硫酸充分反应,生成2g氢气,则这块镁铝合金中镁的质量是 g。
赤铜是一种铜的氧化物,因其外观与铜粉的颜色相似,故名“赤铜”。某兴趣小组欲确证草酸晶体的热分解产物,并测定赤铜的化学式,请你参与过程分析。
【资料】1、草酸晶体(H2C2O4·3H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4·3H2O=CO2↑+ CO↑+ 4H2O
2、浓硫酸具有吸水性,常用作气体干燥剂;无水硫酸铜遇水分变蓝色
(1)下列可用作草酸晶体在浓硫酸作用下加热分解的装置是 (填字母编号)。
a b cd
【问题讨论】
用上图所示装置进行实验(装置C中澄清石灰水足量):
(2)该兴趣小组进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是 。
(3)B装置的作用是 。证明草酸晶体的热分解产物中有CO2的现象是 ,该反应的化学方程式为 。
(4)从环保角度考虑,该套实验装置的明显缺陷是 。
【数据分析与计算】
(5)称取赤铜样品7.2g(假设样品是纯净物),用上述装置进行实验,待赤铜完全反应后,测得E装置玻璃管内固体粉末的质量为6.4克,试计算确定该赤铜的化学式。(写出计算过程)
(6)根据你求出的赤铜化学式,写出E装置中发生反应的化学方程式 。
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 ;
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 (“同意”或“不同意”)小明的观点,因为 ;
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。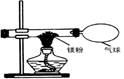
【做出猜想】黄色固体是Mg3N2。
【实验探究】请设计实验,验证猜想:
| 实验操作 |
实验现象及结论 |
【反思与交流】空气中N2含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释:
某研究性学习小组欲利用下列装置进行相关气体制取的探究,请你分析并填空。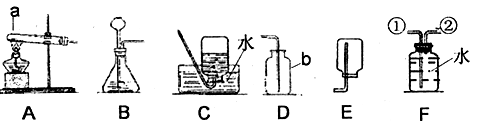
(1)写出图中仪器a、b的名称:a:________,b:________
(2)实验室制取氢气的化学方程式是_______________________,若用排空气法收集氢气,应选择的收集装置是__________.B装置中的长颈漏斗末端位于液面下的原因是___________________.
(3)实验室采用加热氯酸钾和二氧化锰的固体混合物制取氧气,反应化学方程式是______________________.将装置A和C连接进行此实验,实验结束,停止加热前要先将导管移出水面,目的是__________________.若用盛满水的F装置收集氧气,应从导管________(填①或②)通入。
(4)甲烷(CH4)是一种无色、无味、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物的方法制取甲烷,应选择的发生装置是________.
(5)实验室制备CO2应选择的发生装置为________,若是用D收集CO2检验是否收集满的方法为_________________.
在学习“石灰石和钟乳石”时,小明和老师做了如下图所示的一组对比实验。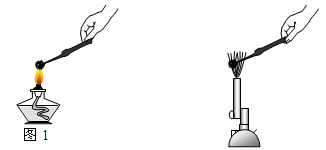
| 实验操作 |
实验现象 |
|
| 小明 |
用坩埚钳夹持一小块石灰石,在酒精灯的火焰上灼烧(如图1所示),2分钟后,把它投入含有酚酞的蒸馏水中 |
酚酞溶液不变色 |
| 老师 |
用坩埚钳夹持一小块石灰石,在酒精喷灯火焰上灼烧(如图2所示),2分钟后,把它投入含有酚酞的蒸馏水中 |
酚酞溶液变红 |
根据上述实验回答下列问题:
(1)小明的实验现象说明石灰石灼烧时没有反生化学反应,其本质原因是 ;
(2)老师的实验中酚酞溶液变红,说明溶液呈 性,用化学方程式表示其原因
(3)若老师实验时夹持的石灰石质量为10克,灼烧完全后剩余固体为5.6克(所含杂质在灼烧过程中不发生变化),请回答下列问题:
① 当石灰石完全反应后,生成CO2的物质的量为 mol;
② 求该石灰石中CaCO3的物质的量(根据化学方程式列式计算)。
某兴趣小组做以下实验探究分子的运动:
(1)实验(如图1所示):烧杯 (填序号)中溶液会由无色变红色,产生这一现象的原因是: 。
(2)为使实验结论准确可靠,该兴趣小组设计了实验(如图2所示)作为对比实验,你认为有无必要?说明理由 。