基本实验及原理分析:
(1)实验室常用下列装置制取和收集气体。

①仪器X的名称是 。
②实验室用 制取 ,应选用的发生和收集装置是 (填标号)。
③C是一种多功能装置,可用于气体的收集和气体的除杂洗气等。若用C装置排空气法收集 ,气体应从 (填“a”或“b”)端进,另一端出。若用C装置干燥 ,气体应从 (填“a”或“b”)端进,另一端出。
(2)某实验小组同学在实验活动中对溶液的酸碱性进行检验,分别检验以下溶液的酸碱性:a.稀盐酸 b.稀硫酸 c.氢氧化钠溶液 d.澄清石灰水 e.氯化钠溶液 f.碳酸钠溶液。
④在该实验中检验溶液的酸碱性最合适的是 (填标号)。
A.pH试纸
B.无色酚酞溶液
C.紫色石蕊溶液
⑤该组同学在活动中发现溶液酸碱性规律:酸溶液呈酸性,碱溶液呈碱性,盐溶液中氯化钠溶液呈中性,而碳酸钠溶液呈碱性。对碳酸钠溶液呈碱性的原因产生分歧:
猜想一:碳酸钠溶液自身呈碱性。
猜想二:碳酸钠溶液中混有氢氧化钠。
进一步设计实验来探究:在以上碳酸钠溶液中加入足量的氯化钙溶液(经检验氯化钙溶液呈中性),充分反应后再检测溶液的酸碱性。实验结果溶液呈中性,则 (填“猜想一”或“猜想二”)成立。
请你对盐溶液的酸碱性进行评价: 。
化学课外小组设计了一套如图所示的气体发生及收集装置,并探究该装置的多功能性.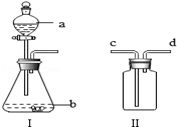
(1)甲同学认为装置Ⅰ可作为实验室制取O2的发生装置,则Ⅰ的a仪器中应加入 ,b仪器中应加入 ,反应的化学方程式为 ,装置Ⅱ中从 管口进气即可作为O2的收集装置.
(2)乙同学认为装置Ⅰ可作为实验室制取二氧化碳的发生装置,则Ⅰ的a仪器应加入 ,b仪器中应加入 .
(3)如果要用装置Ⅱ收集H2,则应从 管口进气.
有一包固体粉末,可能含有氧化钙、氯化钠、碳酸钠、硫酸钠中的一种或几种。为确定其组成,小杨设计出实验方案,实验步骤及现象如下。请回答:
(1)写出步骤④中产生白色沉淀的化学方程式______。
(2)根据实验中的现象,能否确定原固体粉末的组成?若能,请写出各成分的化学式;若不能,在原实验步骤的基础上,对上述方案中的试剂作一改进,并描述相应的实验现象及结论,以确定固体粉末的组成。____________。
如图所示为实验室常见气体制备,净化、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器).某学校两个化学实验探究小组的同学欲用他们完成各自的探究实验.
(1)第一组的同学以石灰水和稀盐酸为原料,在实验室中制备、收集干燥纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性.(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收).
①所选仪器的连接顺序为 → → → (填写仪器序号字母).
②若将二氧化碳通入澄清的石灰水中,石灰水的pH将 (填“增大”“减小”“不变”之一).
(2)第二组的同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,并对某种塑料的组成元素进行分析探究(资料显示该塑料只含C,H,O三种元素),所选仪器按“A→B1→E→B2→D→碱石灰干燥管”的顺序连接,(B1,B2为浓硫酸洗气瓶),实验前检验装置气密性.使该塑料试样碎屑在纯氧气中充分燃烧,观察现象,收集有关实验数据(假设发生的化学反应都充分反应),试回答下列问题:
①仪器A中所发生反应的化学方程式为: ;
②仪器E的玻璃管中放入的塑料试样碎屑质量为mg,塑料试样充分燃烧后,测得仪器D质量增加ag,则mg该塑料试样中含碳元素的质量为 g(计算结果可为分数形式).
③若装置中没有连接仪器B1,这样测算出的该塑料试样中氢元素的质量与实际值比较将(填“偏小”“偏大”“基本一致”之一).
小明设计了如下图所示的实验装置来证明氧化铜也能加快过氧化氢溶液的分解,并与相同条件下MnO2的催化效果做比较,实验时间均以生成30 mL气体为准(即比较反应的快慢程度)。
用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
| 实验序号 |
过氧化氢溶液体积 |
催化剂 |
待测数据 |
| ① |
15mL |
无 |
|
| ② |
15mL |
CuO(0.5g) |
|
| ③ |
15mL |
MnO2(0.5g) |
(1)检查图(Ⅰ)装置气密性的方法是: ;
实验②操作时图(Ⅰ)装置中加入药品和试剂的先后顺序是, (用化学式填写);
(2)图(Ⅱ)装置中油层的作用是阻止氧气与水的接触,防止氧气 。
从设计原理看,实验中的“待测数据”是指 。
(4)如果要进一步探究CuO是否是该反应的催化剂,根据催化剂的定义,请完成下列实验。
| 实验步骤和现象 |
设计这一步骤的目的 |
| (1)取15mL过氧化氢溶液,加入0.5g CuO后,产生O2的速率比未加入时快得多 |
CuO能加快过氧化氢溶液的分解 |
现有某黄铜(铜锌合金,假定其他成分均不与盐酸反应)样品,请从下图中选择适当的实验装置,设计最简单的实验测定该黄铜样品中锌的质量分数并回答下列问题:
(1)写出仪器a的名称: 。
(2)实验要选择的装置是 (填装置编号)。若产生的气体从左向右流,则接口的顺序为 (填接口字母代号);
(3)细心观察发现:盛装溶液的试剂瓶与收集气体的集气瓶都有磨砂部分,所不同的是集气瓶的磨砂部分位于 。
a.瓶底内壁b.瓶口边缘 c.瓶颈内壁d.瓶底外壁
(4)仪器组装好后,在开始实验时,要先 。
(5)若实验样品的质量是9.9g,实验中测定氢气的体积是1.1L(氢气密度为0.09g/L),则该黄铜样品中锌的质量分数为 。