结合实验室常用仪器回答下列问题。

(1)用于引流的仪器 (填序号);
(2)加热时应放置石棉网的仪器是 (填序号);
(3)用②量取10mL液体时,俯视读数,则实际量取的液体体积 (填“大于”“小于”或“等于”)10mL。
实验室现有高锰酸钾、二氧化锰、稀盐酸、用石蕊试液染成紫色的湿润纸花、火柴、棉花及以下仪器:
(1)若补充一种仪器(填名称),并利用上述部分仪器和药品可制取一种气体,待气泡时,开始收集气体,反应的化学方程式为;
(2)若补充一种药品,还能制取二氧化碳,并探究其性质。(见图)
①请连接
和
,并将制取装置图补充完整;
②
中的实验现象是。
"创新是一个民族发展的不竭动力",创新能力是现代经济社会发展对学生提出的最迫切要求.如图是某学生的创新实验--白磷在水下燃烧的实验装置示意图.请分析图回答问题:
(1)实验过程中,甲装置中的白磷并不燃烧,而将甲装置倒转(如乙装置所示),并,即可观察到白磷在"沸腾"的水中燃烧.
(2)通过上述实验,说明可燃物燃烧必须同时满足温度达到可燃物的和与氧气接触两个条件.
(3)在其它条件和操作不变的情况下,只将甲装置中导管C的一端改为插入锥形瓶B的底部进行同样的实验.你认为这一改进后的实验(选填"能"或"不能")成功.
实验是学习化学的重要方法.在实验室里,常采取分解过氧化氢(
)溶液的方法制取氧气.请分析图回答问题: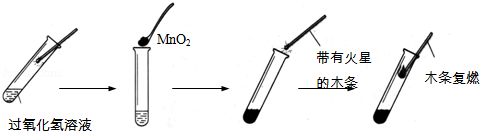
(1)
在上述实验中所扮演的角色是.
| A. |
反应物 |
B. |
生成物 |
C. |
催化剂 |
(2)图中能使带火星的木条复燃的气体是.
(3)写出过氧化氢溶液快速分解的化学方程式.
用图1和图2所示装置分别制取适量
和
气体.请回答下列问题.
(1)
中
的作用是.
(2)写出
、
中发生反应的化学方程式,
:;
:.
(3)按实验要求完成下表内容(不需要的可以不填).
如图是实验室常见的制取气体的装置:
(1)写出图中带标号仪器的名称:
.
(2)若用
装置作发生装置制氧气的化学方程式为,可用E装置收集氧气的原因是.
(3)若用大理石和浓度较大的盐酸制取
时,为了得到纯净、干燥的
,娟娟同学在
装置后连续接了两个
装置再连接
进行收集,她第一个
装置的作用是,她第二个
装置应该注入足量的.